Кпп дз 98: Коробка перемены передач (КПП) ДЗ.98.10.04.000 на автогрейдер ДЗ-98
КПП автогрейдера ДЗ-98 – Полезные статьи от Лидера
Автогрейдер модели ДЗ-98 тяжелого типа – это отличная техника, позволяющая быстро и просто выполнять большой объем работы. Аппарат позволяет работникам укладывать дорожное покрытие, широко применяется оборудование и в железнодорожном строительстве. Также техника отыскала применение и в аэродромном строительстве, в мелиоративной, ирригационной отраслях и во многих других.
Эта модель была создана на основе автогрейдера Д-395.
Что можно сказать об кпп автогрейдера дз 98?
Коробка передач, редуктор привода гидронасосов и обычный раздаточный редуктор соединены в единый блок. Все модели унифицированы и прекрасно работаю. Отличаются надежной коробкой передач, мощным двигателем. Используется в модели механическая КПП, имеется также и мультипликатор. Подобное сочетание позволяет использовать шесть передач.
Все компоненты, связанные в едины блок, имеют и общую схему смазывания. Передача мощности производится посредством карданной передачи и эту опцию можно легко отключить в случае необходимости.
Конструкция машины
Состоит автогрейдер из следующих элементов: двигатель, выпуска газа, карданной передачи, сцепления, коробки передач, раздаточной коробки, среднего, переднего и заднего мостов, ходовой части и так далее.
Какова область применения представленной техники?
Машина способна выполнять огромные объемы работ за короткий срок даже в тяжелых условиях. Где чаще всего используется агрегат?
- При ремонтных работах гравийных и грунтовых дорог, а также во время их строительства;
- Для перемещения земли в насыпь;
- Для планирования поверхностей больших площадей;
- Для разравнивания насыпного грунта;
- При кирковании;
- Для очистки дорог от снега.
Модель изготавливается с учетом климатических условий и может быть выполнена в двух вариантах:
- Обычное исполнение.
 Позволяет использовать технику при -45 и при +40 Градусов Цельсия.
Позволяет использовать технику при -45 и при +40 Градусов Цельсия. - Тропическое исполнение. Подобная техника применяется в местах, где влажный тропический и сухой климат.
Какие выгодные стороны имеются у автогрейдера?
- Включена реализация механического КПП с возможным переключением фрикционных муфт.
- Рулевая колонка легко регулируется, поэтому оператору будет комфортно управлять техников.
- Можно в кабинке оператора установить новые и ультрасовременные удобные кресла, кондиционер, что очень удобно, особенно во время работы в жаркий период времени.
- КПП дз 98 автогрейдер дз 98 имеет шесть передач вперед и назад.
- Передний ведущий мост позволяет максимально комфортно применять сцепную массу техники и обеспечивается высокая проходимость.
- Колесные тормоза не требуют никакой регулировки.
Перейти к каталогу запчастей для Автогрейдера ДЗ-98
Где отыскать на данную модель запчасти?
 Но, проще просто обратится в нашу компанию, и получить отличное обслуживание и прекрасного качества детали. Вся наша продукция сертифицирована, сертификаты мы выставили на сайте.
Но, проще просто обратится в нашу компанию, и получить отличное обслуживание и прекрасного качества детали. Вся наша продукция сертифицирована, сертификаты мы выставили на сайте.У нас в магазине имеется широчайший ассортимент разных запчастей для всевозможных автогрейдеров. Вы отыщите здесь все, что вам необходимо!
У вас возник вопрос по товару? Тогда свяжитесь с нашими сотрудниками посредство обратного звонка или напишите им электронное письмо. Наши специалисты настоящие профессионалы и прекрасно осведомлены об особенностях каждого товара. Они ответят на все ваши вопросы, разъяснят преимущества того или иного элемента. Мы работаем пять дней в неделю, поэтому в эти дни вы можете связаться с нами.
Доверьтесь нашим профессионалам, и мы вас не подведем!
Комплект прокладок КПП ДЗ-98
| Комплект прокладок КПП для автогрейдера ДЗ-98. |
|
Комплект прокладок КПП используется в коробке передач ДЗ-98 со стороны муфты сцепления; КПП ДЗ-98 со стороны раздаточного редуктора; КПП ДЗ-98 спереди (корпус, крышка и валы).
Купить запчасти различных модификаций и исполнений Вы можете в компании ООО “Уралкрандеталь”. Цены производителя. Гарантия. Организуем доставку комплекта прокладок КПП б/н на автогрейдер ДЗ-98 в города Уфа, Саранск, Якутск, Владикавказ, Казань, Кызыл, Ижевск, Абакан, Чебоксары, Барнаул, Краснодар, Красноярск, Владивосток, Ставрополь, Хабаровск, Благовещенск, Архангельск, Астрахань, Белгород, Брянск, Владимир, Волгоград, Вологда, Воронеж, Иваново, Ижевск, Иркутск, Калининград, Калуга, Петропавловск-Камчатский, Кемерово, Киров, Кострома, Курган, Курск, Санкт-Петербург, Липецк, Магадан, Москва, Мурманск, Нижний Новгород, Новгород, Новосибирск, Омск, Оренбург, Орел, Пенза, Пермь, Псков, Ростов-на-Дону, Рязань, Самара, Саратов, Южно-Сахалинск, Екатеринбург, Смоленск, Тамбов, Тверь, Томск, Тула, Тюмень, Ульяновск, Челябинск, Чита, Ярославль, Ханты-Мансийск, Анадырь, Салехард, Грозный, Майкоп, Улан-Удэ, Горно-Алтайск, Махачкала, Назрань, Нальчик, Элиста, Черкесск, Петрозаводск, Сыктывкар, Йошкар-Ола, Новый Уренгой, Сургут, Салехард и другие города России, стран СНГ наиболее дешевой и удобной для Вас транспортной компанией.
Если Вы не нашли необходимую запчасть на нашем сайте – свяжитесь с нашими менеджерами. Вас проконсультируют и подберут нужную деталь. Для более оперативной работы, держим большой ассортимент ходовых запчастей на складе в городах Челябинск, Новый Уренгой, Актобе(Республика Казахстан).
Запрос предложений № 2690461 Проведение капитального ремонта коробки передач (ДЗ-98) Автогрейдера ДЗ-98В.0010 АО «Новосибирское карьероуправление согласно прикрепленному тех.заданию
28.11.41.000 Части двигателей внутреннего сгорания с искровым зажиганием, кроме частей авиационных двигателей
28.15.24.131 Коробки передач
28.30.21.110 Тракторы сельскохозяйственные колесные с мощностью двигателя не более 37 кВт
28.30.21.120 Тракторы сельскохозяйственные гусеничные с мощностью двигателя не более 37 кВт
28.30.22.110 Тракторы сельскохозяйственные колесные с мощностью двигателя от 37 кВт до 59 кВт
28.30. 22.120 Тракторы сельскохозяйственные гусеничные с мощностью двигателя от 37 кВт до 59 кВт
22.120 Тракторы сельскохозяйственные гусеничные с мощностью двигателя от 37 кВт до 59 кВт
28.30.23.110 Тракторы сельскохозяйственные колесные с мощностью двигателя более 59 кВт
28.30.23.120 Тракторы сельскохозяйственные гусеничные с мощностью двигателя более 59 кВт
28.92.21.110 Бульдозеры на гусеничных тракторах
28.92.21.120 Бульдозеры на колесных тракторах и тягачах
28.92.50.000 Тракторы гусеничные
29.32.30.390 Части и принадлежности для автотранспортных средств прочие, не включенные в другие группировки
41.20.20.120 Здания машиностроительных предприятий
42.91.20.190 Работы строительные и ремонтные, связанные с прочими водными сооружениями и работы по ремонту всех вышеуказанных сооружений
45.20.11.000 Услуги по обычному (текущему) техническому обслуживанию и ремонту легковых автомобилей и легких грузовых автотранспортных средств, кроме услуг по ремонту электрооборудования, шин и кузовов
45. 20.21.000 Услуги по обычному (текущему) техническому обслуживанию и ремонту прочих автотранспортных средств, кроме услуг по ремонту электрооборудования и кузовов
20.21.000 Услуги по обычному (текущему) техническому обслуживанию и ремонту прочих автотранспортных средств, кроме услуг по ремонту электрооборудования и кузовов
45.20.11.212 Услуги по ремонту двигателей (кроме деталей электрообородования, шин и кузовов)
45.20.11.213 Услуги по ремонту коробки перемены передач (КПП)
45.20.21.213 Услуги по ремонту коробки перемены передач (КПП)
| КОРОБКА ПЕРЕКЛЮЧЕНИЯ ПЕРЕДАЧ | ||
|---|---|---|
| Каталожный номер | Наименование | Цена с НДС |
| Д395Б.04.031 | BAЛ | |
| Д395Б.04.040 | BAЛ | |
| Д395Б.04.044 | BAЛ | |
| ДЗ.98.10.04.169 | BAЛ | |
| Д395В.10.04.160 | BAЛ B CБOPE | |
| Д395В.10.04.170 | BAЛ B CБOPE | |
ДЗ. 98А.10.04.188 98А.10.04.188 | BAЛ BEДУЩИЙ | |
| ДЗ.98А.10.04.540 | BAЛ BEДУЩИЙ | |
| Д395Б.04.050 | BAЛ MУЛЬTИПЛИKATOPA B CБ | |
| Д395Б.04.030 | BAЛ PEBEPCA B CБOPE | |
| Д395В.10.04.029 | BAЛ.ШECTEPHЯ | |
| Д395В.10.04.023.1 | BAЛИK | |
| ДЗ.98.10.04.135 | BAЛИK | |
| ДЗ.98.10.04.360 | BAЛИK B CБOPE | |
| Д395Б.04.180 | BИЛKA | |
| Д395В.10.04.019.1 | BИЛKA | |
| Д395В.10.04.021 | BИЛKA | |
| ДЗ.98.10.04.018 | BИЛKA | |
| 067.13.12.091 | ГАЙКА ПРОРЕЗНАЯ | |
| 067.13.13.062 | ГАЙКА КРУГЛАЯ | |
| Д395Б.04.109 | CTAKAH | |
| Д395Б.04.123 | CTAKAH | |
Д395Б. 04.124 04.124 | CTAKAH | |
| Д395Б.04.131 | CTAKAH | |
| Д395В.10.04.031.1 | CTAKAH | |
| Д395Б.04.071 | CУXAPИK | |
| ДЗ.98.10.04.000 | KOPOБKA ПEPEMEHЫ ПEPEДAЧ | |
| Д395В.10.04.130 | KPOHШTEЙH B CБOPE | |
| Д395Б.04.108 | KPЫШKA | |
| Д395Б.04.117.1 | KPЫШKA | |
| Д395Б.04.139 | KPЫШKA | |
| Д395В.10.04.007.1 | KPЫШKA | |
| Д395В.10.04.013.1 | KPЫШKA | |
| ДЗ.98.10.04.175 | KPЫШKA | |
| Д395В.10.04.050 | MEXAHИЗM ПEPEKЛЮЧ.PEBEPCA | |
| Д395В.10.04.010 | MEXAHИЗM ПEPEKЛЮЧ.ПEPEДAЧ | |
| Д395Б.04.013.1 | MУФTA | |
| Д395Б.04.046 | MУФTA | |
Д395Б. 04.127 04.127 | MУФTA | |
| Д395В.10.04.033 | MУФTA | |
| ДЗ.98А.10.04.510 | MУФTA | |
| ДЗ.98.10.04.340 | PЫЧAГ | |
| ДЗ.98.10.04.430 | PЫЧAГ | |
| ДЗ.98.10.04.440 | PЫЧAГ | |
| ДЗ.98.10.04.450 | PЫЧAГ | |
| Д395Б.04.069 | ПAЛEЦ | |
| ДЗ.98.10.04.062 | ПPУЖИHA | |
| Д395Б.04.089 | РЫЧAГ | |
| Д395Б.04.014 | ФИKCATOP | |
| Д395В.10.04.015 | ФИKCATOP | |
| Д395В.10.05.080 | ФЛAHEЦ | |
| ДЗ.98А.10.04.530 | ФЛAHEЦ | |
| ДЗ.98.10.04.129 | ЦAHГA | |
| ДЗ.98.10.04.131 | ЦAHГA | |
| Д395Б.04.032 | ШECTEPHЯ | |
Д395Б. 04.035 04.035 | ШECTEPHЯ | |
| Д395Б.04.038 | ШECTEPHЯ | |
| Д395Б.04.039 | ШECTEPHЯ | |
| Д395Б.04.045 | ШECTEPHЯ | |
| Д395Б.04.047 | ШECTEPHЯ | |
| Д395Б.04.135 | ШECTEPHЯ | |
| ДЗ.98.10.04.167 | ШECTEPHЯ | |
| Д395Б.04.007 | ШECTEPHЯ 1.Й ПEPEДAЧИ | |
| Д395Б.04.008 | ШECTEPHЯ 2.Й ПEPEДA4И | |
| ДЗ.98.10.04.166 | ШECTEPHЯ 3.Й ПEPEДAЧИ | |
| Д395Б.04.011 | ШECTEPHЯ PEBEPCA | |
| Д395Б.04.042 | ШECTEPHЯ | |
| Д395Б.04.041 | ШECTEPHЯ | |
| Д395Б.04.033.1 | ШПOHKA | |
| Д395Б.04.036.1 | ШПOHKA | |
| Д395Б.04.043 | ШПOHKA | |
| 3 616 | ПОДШИПНИК | |
| 6-312 | ПОДШИПНИК | |
| 6-313 | ПОДШИПНИК | |
| 30х42х44 | ПОДШИПНИК | |
| 212 | ПОДШИПНИК | |
| 6-115 | ПОДШИПНИК | |
| 2 411 | ПОДШИПНИК | |
| 312 | ПОДШИПНИК | |
| 92317К | ПОДШИПНИК | |
| 2 315 | ПОДШИПНИК | |
| 219 | ПОДШИПНИК | |
Неоднородности в активации контрольной точки клеточного цикла после лечения доксорубицином Выявлены целевые уязвимости в мутантных TP53 клеточных линиях нейробластомы сверхвысокого риска клеточный цикл.
 Таким образом, нарушения в регуляции клеточного цикла могут привести к резистентности к лечению. Здесь всесторонний анализ активации контрольных точек клеточного цикла после лечения доксорубицином (доксо) был проведен с использованием проточной цитометрии, иммунофлуоресценции и визуализации живых клеток на панели TP53 мутантных клеточных линий нейробластомы сверхвысокого риска (NB), SK-N -DZ, Келли, SK-N-AS, SK-N-FI и BE(2)-C.После лечения наблюдалось дозозависимое накопление либо в S-, либо в G2/M-фазе. Это совпало с гетерогенным увеличением белков контрольных точек клеточного цикла, т. е. phos-ATM, phos-CHK1, phos-CHK2, Wee1, p21 Cip1/Waf1 и p27 Kip среди клеточных линий. Комбинированное лечение доксо и низкомолекулярным ингибитором АТМ показало задержку повторного роста в SK-N-DZ, CHK1 в BE(2)-C, Wee1 в SK-N-FI и BE(2)-C, и p21 у Kelly и BE(2)-C. Дальнейшее исследование выявило во всех протестированных клеточных линиях подмножество клеток, остановленных в митозе, что указывает на независимость от внутри-S- и/или G2/M-контрольных точек.
Таким образом, нарушения в регуляции клеточного цикла могут привести к резистентности к лечению. Здесь всесторонний анализ активации контрольных точек клеточного цикла после лечения доксорубицином (доксо) был проведен с использованием проточной цитометрии, иммунофлуоресценции и визуализации живых клеток на панели TP53 мутантных клеточных линий нейробластомы сверхвысокого риска (NB), SK-N -DZ, Келли, SK-N-AS, SK-N-FI и BE(2)-C.После лечения наблюдалось дозозависимое накопление либо в S-, либо в G2/M-фазе. Это совпало с гетерогенным увеличением белков контрольных точек клеточного цикла, т. е. phos-ATM, phos-CHK1, phos-CHK2, Wee1, p21 Cip1/Waf1 и p27 Kip среди клеточных линий. Комбинированное лечение доксо и низкомолекулярным ингибитором АТМ показало задержку повторного роста в SK-N-DZ, CHK1 в BE(2)-C, Wee1 в SK-N-FI и BE(2)-C, и p21 у Kelly и BE(2)-C. Дальнейшее исследование выявило во всех протестированных клеточных линиях подмножество клеток, остановленных в митозе, что указывает на независимость от внутри-S- и/или G2/M-контрольных точек. В совокупности мы нанесли на карту различные контрольные точки клеточного цикла в клеточных линиях NB со сверхвысоким риском и определили зависимые от контрольных точек и независимые мишени, поддающиеся лечению.
В совокупности мы нанесли на карту различные контрольные точки клеточного цикла в клеточных линиях NB со сверхвысоким риском и определили зависимые от контрольных точек и независимые мишени, поддающиеся лечению.Ключевые слова: АТМ, остановка клеточного цикла, повреждение ДНК, лекарственная устойчивость, нейробластома высокого риска, митотическая остановка, р21, пролиферация
1. Введение
ранее детство. Это гетерогенная неоплазия с клинической картиной, варьирующей от спонтанной регрессии метастатического заболевания до быстро прогрессирующего течения [1].Пятьдесят процентов всех детей с диагнозом НБ относятся к группе высокого риска. Среди NB высокого риска около 19 % считается подмножеством сверхвысокого риска, определяемого как смерть от заболевания в течение 18 месяцев после постановки диагноза, несмотря на интенсивное лечение [2]. Кроме того, частота рецидивов НБ высокого риска достигает 50%, несмотря на интенсивное мультимодальное лечение, и часто характеризуется резистентностью к терапии и внутриопухолевым разнообразием, что затрудняет излечение [3,4]. NB сверхвысокого риска и рецидив NB остаются терапевтическими проблемами, и только ограниченные данные об эффективных спасательных терапиях [5].
NB сверхвысокого риска и рецидив NB остаются терапевтическими проблемами, и только ограниченные данные об эффективных спасательных терапиях [5].Низкомолекулярные ингибиторы киназы анапластической лимфомы (ALK), антитела против NB-антигена GD2 и радиоактивно меченные аналоги соматостатина [6,7] представляют собой новые таргетные стратегии, но химиотерапия (ХТ) продолжает оставаться краеугольным камнем системного лечения NB. Антрациклин доксорубицин (доксо) включен в широкий спектр протоколов лечения рака у детей и взрослых и является признанной терапией спасения, если индукционная КТ без антрациклина не эффективна [8]. Doxo реализует свою функцию посредством интеркаляции ДНК, индукции разрывов цепей ДНК, прямого ингибирования топоизомеразы II и образования свободных радикалов, причем наиболее существенным эффектом является индукция повреждения ДНК [9].
Повреждение ДНК приводит к активации механизмов надзора за контрольными точками клеточного цикла, в результате чего клетки либо останавливаются, чтобы обеспечить репарацию ДНК [10], либо подвергаются клеточной гибели, если повреждение ДНК не поддается репарации [11]. Эти контрольные точки включают сигнальные пути, регулируемые различными киназами, а именно мутированной серин/треонинкиназой атаксии и телеангиэктазии (ATM) и киназами контрольных точек 1 и 2 (CHK1/2) [12]. Киназы CHK1/2 осуществляют непрямой контроль контрольных точек через несколько нижестоящих мишеней, включая Wee1 и p21 Cip1/Waf1 (p21), которые, в свою очередь, ингибируют каталитическую активность циклинзависимых киназ [13,14].Следовательно, активация белков контрольных точек клеточного цикла вызывает остановку клеточного цикла [15]. Кроме того, в то время как p21 в основном активируется во время острой остановки, активация члена семейства Cip/Kip p27Kip1 поддерживает длительную остановку после повреждения ДНК [16].
Эти контрольные точки включают сигнальные пути, регулируемые различными киназами, а именно мутированной серин/треонинкиназой атаксии и телеангиэктазии (ATM) и киназами контрольных точек 1 и 2 (CHK1/2) [12]. Киназы CHK1/2 осуществляют непрямой контроль контрольных точек через несколько нижестоящих мишеней, включая Wee1 и p21 Cip1/Waf1 (p21), которые, в свою очередь, ингибируют каталитическую активность циклинзависимых киназ [13,14].Следовательно, активация белков контрольных точек клеточного цикла вызывает остановку клеточного цикла [15]. Кроме того, в то время как p21 в основном активируется во время острой остановки, активация члена семейства Cip/Kip p27Kip1 поддерживает длительную остановку после повреждения ДНК [16].
Хотя белки контрольных точек поддерживают целостность генома, нарушение регуляции может быть связано с резистентностью к терапии [17]. Среди распространенных генетических изменений 50% NB высокого риска имеют амплификацию онкогена MYCN, который способен активировать транскрипцию белков контрольных точек, включая CHK1, после лечения. Это указывает на то, что эти подмножества NB-клеток высокого риска могут получить пользу от лечения, нацеленного на CHK1, что делает его идеальной мишенью для терапевтического вмешательства [1,18,19]. Напротив, многие белки контрольных точек, включая ATM и CHK1, кодируются на 11q, который обычно теряется в НБ высокого риска, что приводит к снижению экспрессии этих белков [20]. Вместо этого соответствующие сигнальные пути могут быть компенсированы функцией другого компенсаторного контрольного пункта. Кроме того, в то время как изменения либо в MYCN, либо в 11q обычно присутствуют при постановке диагноза, мутации TP53 (mut) при постановке диагноза встречаются редко, встречаясь в <2% случаев независимо от стадии опухоли [21].Вместо этого аномалии пути р53, в том числе мутация TP53 , выявляются в 49% НБ после рецидива, что указывает на механистическую значимость развития резистентности к терапии [22]. Кроме того, аномалия пути р53 приводит к дефициту G1/S-контрольной точки, что требует опоры на интра-S- и/или G2/M-контрольную точку для продолжения выживания [23].
Это указывает на то, что эти подмножества NB-клеток высокого риска могут получить пользу от лечения, нацеленного на CHK1, что делает его идеальной мишенью для терапевтического вмешательства [1,18,19]. Напротив, многие белки контрольных точек, включая ATM и CHK1, кодируются на 11q, который обычно теряется в НБ высокого риска, что приводит к снижению экспрессии этих белков [20]. Вместо этого соответствующие сигнальные пути могут быть компенсированы функцией другого компенсаторного контрольного пункта. Кроме того, в то время как изменения либо в MYCN, либо в 11q обычно присутствуют при постановке диагноза, мутации TP53 (mut) при постановке диагноза встречаются редко, встречаясь в <2% случаев независимо от стадии опухоли [21].Вместо этого аномалии пути р53, в том числе мутация TP53 , выявляются в 49% НБ после рецидива, что указывает на механистическую значимость развития резистентности к терапии [22]. Кроме того, аномалия пути р53 приводит к дефициту G1/S-контрольной точки, что требует опоры на интра-S- и/или G2/M-контрольную точку для продолжения выживания [23]. Таким образом, представляет интерес потенциал низкомолекулярных ингибиторов, нацеленных на внутри-S- и/или G2/M-контрольную точку, либо в виде отдельных агентов, либо в комбинации с CT, особенно в TP53 mut NB.
Таким образом, представляет интерес потенциал низкомолекулярных ингибиторов, нацеленных на внутри-S- и/или G2/M-контрольную точку, либо в виде отдельных агентов, либо в комбинации с CT, особенно в TP53 mut NB.
Здесь мы использовали панель из пяти клеточных линий сверхвысокого риска TP53 mut NB, SK-N-DZ, Kelly, SK-N-AS, SK-N-FI и BE(2)-C, для изучения контрольных точек клеточного цикла и способности к повторному росту после лечения доксо. Цель состоит в том, чтобы улучшить понимание состояний, ведущих к резистентности к лечению и рецидивам, а также выявить целевые уязвимые места.
Мы демонстрируем гетерогенность в распределении клеточного цикла среди протестированных клеточных линий после обработки doxo. Кроме того, часть клеток показала активацию белков контрольных точек и чувствительность к химическому ингибированию этих белков.Однако подмножество клеток было способно прогрессировать через S-фазу и останавливаться в митозе, что указывает на независимость внутри-S- и G2/M-контрольных точек. Эти результаты демонстрируют гетерогенность в регуляции клеточного цикла с наличием как зависимых от контрольных точек, так и независимых субпопуляций опухолевых клеток во всех протестированных клеточных линиях. Выявление механизмов ускользания от ХТ не только расширяет знания о химиорезистентности, но и помогает выявить специфические уязвимые места, на которые можно воздействовать в сочетании с традиционной терапией.
Эти результаты демонстрируют гетерогенность в регуляции клеточного цикла с наличием как зависимых от контрольных точек, так и независимых субпопуляций опухолевых клеток во всех протестированных клеточных линиях. Выявление механизмов ускользания от ХТ не только расширяет знания о химиорезистентности, но и помогает выявить специфические уязвимые места, на которые можно воздействовать в сочетании с традиционной терапией.
2. Результаты
2.1. Оценка цитотоксических эффектов после лечения Doxo
Было показано, что цитотоксический эффект doxo сильно различается среди неактивных по p53 клеточных линий NB со значениями IC50 в диапазоне от 0,06 до 0,2 мкМ [24]. Чтобы исследовать устойчивость к доксо-индуцированному апоптозу среди нашей панели из мутантных клеточных линий TP53 , мы измерили фрагментацию ДНК (суб-G1) после 48 часов обработки доксо, серийно разбавленным до 0,01 мкМ, 0,1 мкМ и 1 мкМ, с использованием проточной цитометрии. .Важно отметить, что самая высокая испытанная доза, 1 мкМ, соответствует клинически значимому пиковому уровню в плазме у пациентов [25,26].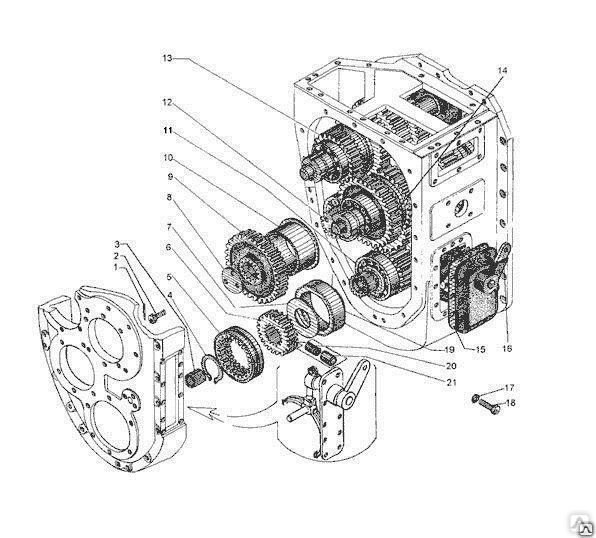
Как показано на рисунках A и A, в культурах SK-N-DZ после 0,1 мкМ и 1 мкМ doxo было обнаружено значительное увеличение фракций суб-G1 по сравнению с контролем (26% и 18% против 5,3%). Келли и SK-N-AS продемонстрировали увеличение фракций суб-G1 после 1 мкМ doxo (от 0,9 до 13%, p <0,01 и от 0,5 до 7,4%, p <0,05 соответственно). Однако SK-N-FI и BE(2)-C не показали изменений во фракциях суб-G1 после любой из тестируемых концентраций.Таким образом, данные свидетельствовали о высокой устойчивости к доксо-индуцированному апоптозу, за исключением клеточных линий SK-N-DZ, Kelly и SK-N-AS, где полной устойчивости не наблюдалось.
Анализ распределения клеточного цикла и возобновления роста в клеточных линиях нейробластомы (NB) после лечения указанными дозами ложного (PBS) или доксо. ( A ) Проточная цитометрия HOECHST 33343 выполнялась на SK-N-DZ, Kelly, SK-N-AS, SK-N-FI и BE(2)-C после имитации обработки (PBS) или титрования doxo при указанные концентрации. Образцы анализировали через 48 часов после обработки. Результаты представлены в виде процентного содержания клеток в каждой фазе клеточного цикла. Самая низкая проверенная доза дала такие же результаты, как и пробная обработка, что указывает на то, что 0,01 мкМ является субоптимальной дозой. Обработка либо 0,1 мкМ, либо 1 мкМ приводила к дозозависимому снижению G0/G1- вместе с накоплением в S- и/или G2/M-фазах для всех протестированных клеточных линий. Среднее из трех экспериментов. ( B ) Культивируемые клетки подвергали указанной обработке (доксо/имитация) и анализировали с помощью визуализации живых клеток с помощью IncuCyte в указанные моменты времени.Слияние показывает клеточную плотность каждой клеточной линии, измеренную в течение 44 дней. Две клеточные линии, SK-N-DZ и Kelly, продемонстрировали в образцах, обработанных имитацией, отслоение от планшетов после достижения высокой степени слияния, что, скорее всего, было связано с эффектами скопления. Самая низкая испытанная доза следовала той же схеме роста, что и при фиктивном лечении.
Образцы анализировали через 48 часов после обработки. Результаты представлены в виде процентного содержания клеток в каждой фазе клеточного цикла. Самая низкая проверенная доза дала такие же результаты, как и пробная обработка, что указывает на то, что 0,01 мкМ является субоптимальной дозой. Обработка либо 0,1 мкМ, либо 1 мкМ приводила к дозозависимому снижению G0/G1- вместе с накоплением в S- и/или G2/M-фазах для всех протестированных клеточных линий. Среднее из трех экспериментов. ( B ) Культивируемые клетки подвергали указанной обработке (доксо/имитация) и анализировали с помощью визуализации живых клеток с помощью IncuCyte в указанные моменты времени.Слияние показывает клеточную плотность каждой клеточной линии, измеренную в течение 44 дней. Две клеточные линии, SK-N-DZ и Kelly, продемонстрировали в образцах, обработанных имитацией, отслоение от планшетов после достижения высокой степени слияния, что, скорее всего, было связано с эффектами скопления. Самая низкая испытанная доза следовала той же схеме роста, что и при фиктивном лечении. После введения либо 0,1 мкМ, либо 1 мкМ все клеточные линии продемонстрировали способность к возобновлению роста, хотя и после продолжительного лаг-периода. Среднее ± SEM пяти экспериментов.
После введения либо 0,1 мкМ, либо 1 мкМ все клеточные линии продемонстрировали способность к возобновлению роста, хотя и после продолжительного лаг-периода. Среднее ± SEM пяти экспериментов.
Таблица 1
Доксо-индуцированный апоптоз (Sub-G1).
| Клеточная линия | Имитация | Doxo 0,01 мкМ | р | Доксо 0,1 мкМ | р | Доксо 1 мкМ | р |
|---|---|---|---|---|---|---|---|
| СК-Н-ДЗ | 5,3 ± 1,2 | 3,6 ± 1,1 | НР | 26 ± 2,5 | **** | 18 ± 11 | ** |
| Келли | 0,9 ± 0,2 | 1.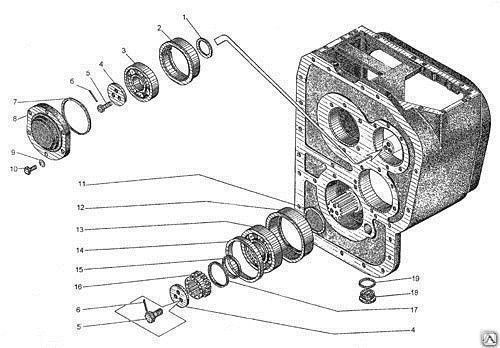 3 ± 0,9 3 ± 0,9 | НР | 7,1 ± 1,4 | НР | 13 ± 7,3 | ** |
| СК-Н-АС | 0,5 ± 0,1 | 1,0 ± 0,4 | НР | 6,5 ± 1,0 | НР | 7,4 ± 2,3 | * |
| СК-Н-ФИ | 11 ± 4,3 | 7,6 ± 2,7 | НР | 16 ± 4,6 | НР | 11 ± 2. 5 5 | НР |
| БЭ(2)-К | 4,3 ± 0,9 | 3,9 ± 1,6 | НР | 12 ± 4,9 | НР | 6,3 ± 1,9 | НР |
2.2. Распределение клеточного цикла и динамика возобновления роста после обработки Doxo
Поскольку предполагается, что доксо-индуцированное повреждение ДНК вызывает остановку клеточного цикла, мы исследовали распределение клеточного цикла после воздействия доксо с помощью проточной цитометрии. Через 48 часов после обработки самой низкой тестируемой дозой (0,01 мкМ doxo) все клеточные линии сохраняли основную массу клеток в G0/G1 (46–66%), аналогично результатам после имитации лечения (51–66%). .
Через 48 часов после обработки самой низкой тестируемой дозой (0,01 мкМ doxo) все клеточные линии сохраняли основную массу клеток в G0/G1 (46–66%), аналогично результатам после имитации лечения (51–66%). .
Обработка промежуточной дозой (0,1 мкМ doxo) приводила к накоплению G2/M-фаз во всех клеточных линиях по сравнению с имитацией обработки (27–66% против 7–15%; p < 0,0001), с уменьшенной популяцией G0/G1 (7–41% против 46–66%; p <0,0001) A и Таблица S3.Кроме того, для Kelly и SK-N-AS заселенность S-фазы была снижена, чего не наблюдалось для SK-N-DZ, SK-N-FI и BE(2)-CA и таблицы S3.
Самая высокая протестированная доза (1 мкМ doxo) показала, как и 0,1 мкМ, снижение уровня диплоидных клеток (G0/G1) во всех клеточных линиях. Примечательно, что все клеточные линии, за исключением BE(2)-C, демонстрировали накопление S-фазы, что свидетельствует об остановке внутри S-фазы. В частности, две клеточные линии, Kelly и SK-N-AS, продемонстрировали высокое предпочтение накопления S-фазы, достигая уровней примерно 70% по сравнению с 30% при фиктивной обработке A и таблице S3. Кроме того, в то время как Kelly и SK-N-AS представляли лишь незначительную долю клеток в G2/M-фазе (6 и 5% соответственно), остальные три клеточные линии, SK-N-DZ, SK-N- FI и BE(2)-C показали одновременное увеличение G2/M-фазы, что указывает на p53-независимую остановку G2/M-фазы A и Таблица S3.
Кроме того, в то время как Kelly и SK-N-AS представляли лишь незначительную долю клеток в G2/M-фазе (6 и 5% соответственно), остальные три клеточные линии, SK-N-DZ, SK-N- FI и BE(2)-C показали одновременное увеличение G2/M-фазы, что указывает на p53-независимую остановку G2/M-фазы A и Таблица S3.
Для определения долгосрочного эффекта лечения doxo были проведены анализы повторного роста. Повторный рост (слияние) был нанесен на карту в течение 44 дней после импульсного лечения имитацией или доксо при 0.01 мкМ, 0,1 мкМ или 1 мкМ в течение 48 часов. Две клеточные линии, SK-N-DZ и Kelly, продемонстрировали отделение от планшетов после достижения высокой степени слияния после имитации обработки, скорее всего, из-за эффектов скопления. После самой низкой протестированной дозы (0,01 мкМ doxo) повторный рост следовал той же схеме роста, что и при имитационной обработке. Более того, для всех клеточных линий, кроме BE(2)-C, наблюдалась зависимость от дозы с лаг-периодом приблизительно 20 дней после 0,1 мкМ doxo и 24 дня после 1 мкМ doxo до увеличения слияния (возобновление роста). Тем не менее, клетки BE(2)-C показали повторный рост на 6-й день после 0,1 мкМ и на 14-й день после 1 мкМ doxo, что указывает на менее выраженный лаг-период по сравнению с другими четырьмя клеточными линиями B. Важно отметить, что продолжительность лаг-периода до повторный рост после лечения doxo не отражал напрямую чувствительность к лекарству, но, по-видимому, в значительной степени зависит от внутренней скорости пролиферации каждой клеточной линии с BE (2)-C, имеющим самое короткое время удвоения, за которым следуют SK-N-DZ, Kelly, SK-N -АС и СК-Н-ФИ.
Тем не менее, клетки BE(2)-C показали повторный рост на 6-й день после 0,1 мкМ и на 14-й день после 1 мкМ doxo, что указывает на менее выраженный лаг-период по сравнению с другими четырьмя клеточными линиями B. Важно отметить, что продолжительность лаг-периода до повторный рост после лечения doxo не отражал напрямую чувствительность к лекарству, но, по-видимому, в значительной степени зависит от внутренней скорости пролиферации каждой клеточной линии с BE (2)-C, имеющим самое короткое время удвоения, за которым следуют SK-N-DZ, Kelly, SK-N -АС и СК-Н-ФИ.
Объединенные данные иллюстрируют гетерогенность среди мутантных клеточных линий TP53 в их реакции клеточного цикла на обработку doxo.Это особенно заметно после обработки 1 мкМ doxo, где SK-N-AS и Kelly накапливаются в S-фазе, SK-N-DZ и SK-N-FI как в S-фазе, так и в G2/M-фазе и BE(2) -C в G2/M-фазе. Кроме того, все клеточные линии продемонстрировали способность к возобновлению роста после всех испытанных концентраций doxo, хотя и с различной кинетикой, указывающей на присутствие резистентных клеток.
2.3. Оценка активации контрольных точек клеточного цикла после обработки Doxo
Затем активацию белков контрольных точек исследовали после обработки doxo путем определения экспрессии ATM-фосфо S1981 (pATM), CHK1-фосфо S296 (pCHK1), CHK2-фосфо T68 (pCHK2 ), Wee1, p21 и p27 Kip1 в одиночных клетках с использованием иммунофлуоресценции.Это было сделано для корреляции доксо-индуцированных изменений в распределении клеточного цикла с активацией интра-S и/или G2/M-контрольных точек.
Через 48 часов после обработки 1 мкМ doxo наблюдалось сильное увеличение количества pATM-позитивных клеток для всех клеточных линий, кроме SK-N-AS. Доля положительных клеток увеличивалась для pCHK1 в Kelly и BE(2)-C, а также для pCHK2, нижележащей мишени ATM, для всех клеточных линий, кроме SK-N-AS. Доля Wee1-позитивных клеток увеличивалась в SK-N-DZ, Kelly и BE(2)-C, а доля p21-позитивных клеток возрастала во всех клеточных линиях, кроме Kelly.Однако у Келли и SK-N-FI была высокая доля p21-позитивных клеток, примерно 20%, после имитации лечения. Обе эти клеточные линии также показали увеличение фракции p27 Kip1 положительных клеток после обработки. В целом, клеточная линия BE(2)-C показала самое высокое увеличение доли клеток, положительных в отношении белков контрольных точек клеточного цикла, после обработки 1 мкМ doxo, и репрезентативные изображения каждого маркера представлены на рис.
Обе эти клеточные линии также показали увеличение фракции p27 Kip1 положительных клеток после обработки. В целом, клеточная линия BE(2)-C показала самое высокое увеличение доли клеток, положительных в отношении белков контрольных точек клеточного цикла, после обработки 1 мкМ doxo, и репрезентативные изображения каждого маркера представлены на рис.
Экспрессия белков контрольных точек клеточного цикла в клетках BE(2)-C после обработки doxo.Культивируемые клетки подвергали указанной обработке (доксо/ложная) и анализировали на экспрессию pATM, pCHK1, pCHK2, Wee1, p21 и p27 через 48 часов. Повышенная экспрессия всех маркеров, кроме p27, наблюдалась в клеточной линии BE(2)-C после обработки. pATM показал высокое увеличение экспрессии (86% положительных клеток), тогда как маркеры pCHK1, pCHK2, Wee1 и p21 обнаруживались с низкой частотой (от 6 до 21% положительных клеток). Масштабная линейка = 20 мкм.
Таблица 2
Анализ белков контрольных точек клеточного цикла после обработки doxo в течение 48 часов.
| pATM | pCHK1 | pCHK2 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Клеточная линия | Макет | Доксо | р | Макет | Доксо | р | Макет | Доксо | р | |||
| СК-Н-ДЗ | 1,2 ± 0,3 | < | 89 ± 1,5 | **** | 3.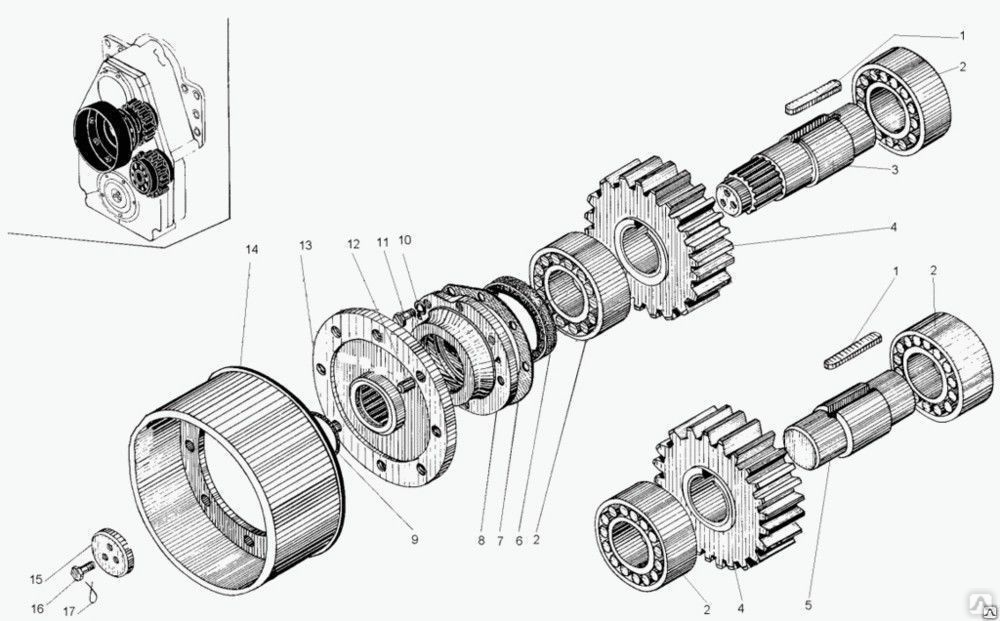 8 ± 1,9 8 ± 1,9 | ≃ | 23 ± 17 | НР | 1.0 ± 0.5 | < | 6.2 ± 1,2 | ** | Kelly | Kelly | 3.1 ± 2.5 | < | 74 ± 2.2 | **** | 0,5 ± 0,1 | < | 15 ± 5,2 | ** | 0,6 ± 0,5 | < | 11 ± 4,0 | ** |
| СК-Н-АС | 1,4 ± 0,8 | ≃ | 3. 1 ± 1,8 1 ± 1,8 | НР | 0,6 ± 0,6 | ≃ | 1,6 ± 0,5 | НР | 0,5 ± 0,2 | < | 1,0 ± 0,6 | НР |
| СК-Н-ФИ | 12 ± 5,5 | < | 82 ± 8,4 | *** | 1,1 ± 0,4 | ≃ | 2,8 ± 2,1 | НР | 5,1 ± 2,5 | < | 33 ± 13 | * |
| BE(2)-C | 7. 2 ± 3,9 2 ± 3,9 | < | 86 ± 9,7 | **** | 0,8 ± 0,5 | < | 11 ± 4,4 | * | 1,3 ± 0,4 | < | 6,4 ± 0,2 | *** |
Таблица 3
Анализ белков контрольных точек клеточного цикла после обработки doxo в течение 48 часов.
| Wee1 | p21 | p27 Kip1 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Cell Line | Mock | Доксо | р | Макет | Доксо | р | Макет | Доксо | р | |||
| СК-Н-ДЗ | 1. 1 ± 0,4 1 ± 0,4 | < | 9,5 ± 4,3 | * | 2,6 ± 1,0 | < | 29 ± 8,0 | ** | 0,4 ± 0,3 | ≃ | 4,0 ± 3,2 | НР |
| Келли | 0,2 ± 0,1 | < | 1,2 ± 0,4 | * | 18 ± 2,2 | ≃ | 23 ± 13 | НР | 0,1 ± 0,1 | < | 1. 4 ± 0,3 4 ± 0,3 | ** |
| СК-Н-АС | 0,1 ± 0,2 | ≃ | 0,2 ± 0,0 | НР | 2,5 ± 0,8 | < | 28 ± 3,0 | *** | 0,0 ± 0,0 | ≃ | 0,1 ± 0,1 | НР |
| СК-Н-ФИ | 1,1 ± 0,4 | ≃ | 1,6 ± 0,2 | НР | 23 ± 1,5 | < | 34 ± 3. 9 9 | ** | 2,3 ± 0,1 | < | 6,3 ± 1,1 | ** |
| BE(2)-C | 2,1 ± 1,0 | < | 10 ± 3,8 | * | 2,0 ± 0,9 | < | 21 ± 1,6 | **** | 0,7 ± 1,2 | ≃ | 0,2 ± 0,2 | НР |
Эти результаты показывают, что доксо-индуцированная частота клеток, положительных в отношении белков контрольных точек клеточного цикла, pCHK1, pCHK2, Wee1, p21 и p27 Kip1 , в целом была низкой, за исключением pATM, который был сильно повышен для всех клеток. линии, кроме СК-Н-АС.
линии, кроме СК-Н-АС.
2.4. Чувствительность к ингибиторам белков контрольных точек клеточного цикла в сочетании с обработкой Doxo
Увеличение числа положительных клеток по одному или нескольким белкам контрольных точек клеточного цикла было показано после обработки doxo для всех клеточных линий NB, что указывает на их роль в доксо-индуцированных клетках. остановка цикла.
Для проверки функциональной роли белков контрольных точек клеточного цикла мы использовали фармакологические ингибиторы. С целью оценки влияния ингибиторов на жизнеспособность НБ и рост.Небольшой молекулярный ингибитор p27 Kip1 коммерчески недоступен.
Эффективность каждого лекарственного средства тестировали в качестве монотерапии с использованием 4-логарифмического анализа жизнеспособности клеток доза-реакция с временной точкой 72 часа. Ингибирование ATM или p21 не приводило к снижению жизнеспособности клеток после обработки ни для одной из клеточных линий. Однако все протестированные клеточные линии NB были чувствительны к однокомпонентному ингибированию CHK1, CHK1/2 или Wee1 по сравнению с имитацией лечения.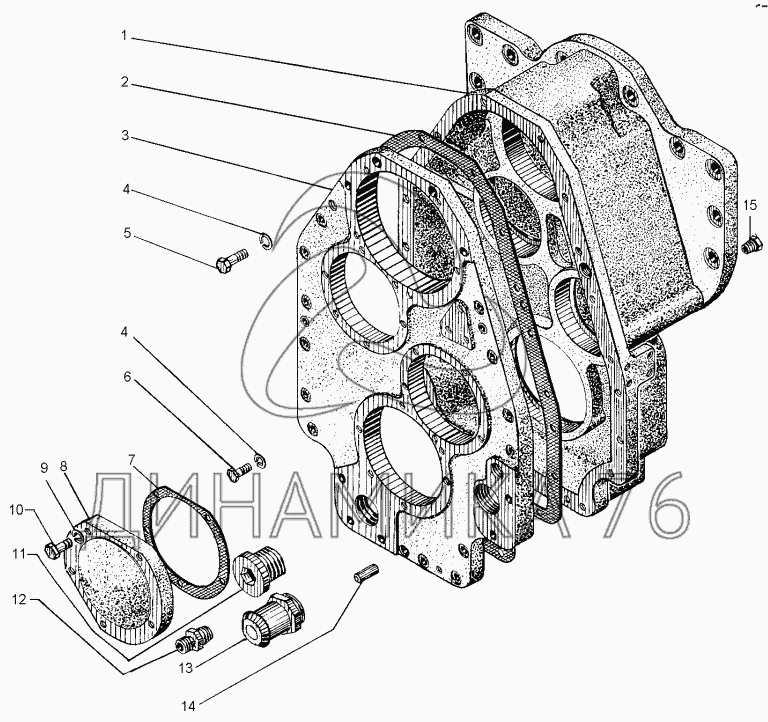 Келли и SK-N-AS показали наибольшую чувствительность, за ними следуют SK-N-DZ, SK-N-FI и BE(2)-CA.
Келли и SK-N-AS показали наибольшую чувствительность, за ними следуют SK-N-DZ, SK-N-FI и BE(2)-CA.
Анализ жизнеспособности клеток и анализ долгосрочного клеточного роста (слияния) на клеточных линиях NB после обработки ингибиторами белков контрольных точек клеточного цикла. Линии клеток NB обрабатывали химическими ингибиторами ATM, CHK1, CHK1/2, Wee1 или p21. ( A ) Значения IC50 рассчитывали с использованием анализа MTS через 72 ч после обработки как концентрацию лекарственного средства, необходимую для ингибирования 50% жизнеспособности клеток по сравнению с обработанными имитациями клеток. Ни одна из клеточных линий не проявляла чувствительности к ATMi или p21i.Kelly и SK-N-AS показали самую высокую чувствительность к CHK1i, CHK1/2i и Wee1i, за ними следуют SK-N-DZ, SK-N-FI и BE(2)-C. N = 3. ( B ) Линии клеток NB обрабатывали ингибиторами ATMi, CHK1i, CHK1/2i, Wee1i или p21i. Восстановление роста измеряли в течение 44 дней с помощью IncuCyte («значение слияния» указывает на плотность клеток). Все клеточные линии, за исключением SK-N-AS, показали снижение роста после комбинированной обработки доксо по сравнению с однократной обработкой доксо. BE(2)-C показал наибольшую чувствительность к ингибиторам.Среднее значение ± стандартное отклонение пяти экспериментов. * = p < 0,05, ** = p < 0,01, *** = p < 0,001, **** = p < 0,0001, NS = не значимо p > 0,0006. Стьюдента t -тест. Двухфакторный дисперсионный анализ с пост-тестами Бонферрони.
Все клеточные линии, за исключением SK-N-AS, показали снижение роста после комбинированной обработки доксо по сравнению с однократной обработкой доксо. BE(2)-C показал наибольшую чувствительность к ингибиторам.Среднее значение ± стандартное отклонение пяти экспериментов. * = p < 0,05, ** = p < 0,01, *** = p < 0,001, **** = p < 0,0001, NS = не значимо p > 0,0006. Стьюдента t -тест. Двухфакторный дисперсионный анализ с пост-тестами Бонферрони.
Текущие стратегии разработки ингибиторов белков контрольных точек клеточного цикла были сосредоточены на их химиосенсибилизирующих свойствах. Здесь была проведена последовательная оценка способности молекулярных ингибиторов потенцировать CT doxo на панели клеточных линий NB.Каждый ингибитор объединяли в концентрации 10 мкМ для ATMi и p21i или соответствующее значение IC50 с 1 мкМ doxo, и измеряли клеточный рост (конфлюэнтность) в течение 44 дней.
Значительная задержка роста наблюдалась в клеточной линии SK-N-DZ после комбинированной обработки doxo и ATMi по сравнению с однократной обработкой doxo ( p < 0,05–0,0001). Kelly продемонстрировал задержку роста после комбинированного лечения doxo и p21i ( p < 0,05), а BE(2)-C показал задержку роста после комбинированного лечения doxo и либо CHK1i ( p < 0,05).05–0,0001), Wee1i ( p < 0,05–0,0001) или p21i ( p < 0,05–0,0001). SK-N-FI показал начальную задержку роста (между 2–6 днями, p <0,05–0,0001) после комбинированного лечения doxo и Wee1i, однако этого не наблюдалось с 8 дня эксперимента и позже. Ни одна из комбинированных обработок не показала задержки роста по сравнению с однократной обработкой doxo в клеточной линии B SK-N-AS. В целом, эти результаты демонстрируют, что все клеточные линии, кроме SK-N-AS, замедляли повторный рост при комбинировании doxo. с ингибитором белков контрольной точки клеточного цикла, что позволяет предположить, что ингибиторы усиливают doxo в подавлении роста.
Kelly продемонстрировал задержку роста после комбинированного лечения doxo и p21i ( p < 0,05), а BE(2)-C показал задержку роста после комбинированного лечения doxo и либо CHK1i ( p < 0,05).05–0,0001), Wee1i ( p < 0,05–0,0001) или p21i ( p < 0,05–0,0001). SK-N-FI показал начальную задержку роста (между 2–6 днями, p <0,05–0,0001) после комбинированного лечения doxo и Wee1i, однако этого не наблюдалось с 8 дня эксперимента и позже. Ни одна из комбинированных обработок не показала задержки роста по сравнению с однократной обработкой doxo в клеточной линии B SK-N-AS. В целом, эти результаты демонстрируют, что все клеточные линии, кроме SK-N-AS, замедляли повторный рост при комбинировании doxo. с ингибитором белков контрольной точки клеточного цикла, что позволяет предположить, что ингибиторы усиливают doxo в подавлении роста.
2.5. Наличие остановки митоза после лечения Doxo
Данные показывают, что существует высокая гетерогенность среди различных клеточных линий, как в отношении их экспрессии белков контрольных точек клеточного цикла, так и в отношении их чувствительности к химическим ингибиторам белков контрольных точек.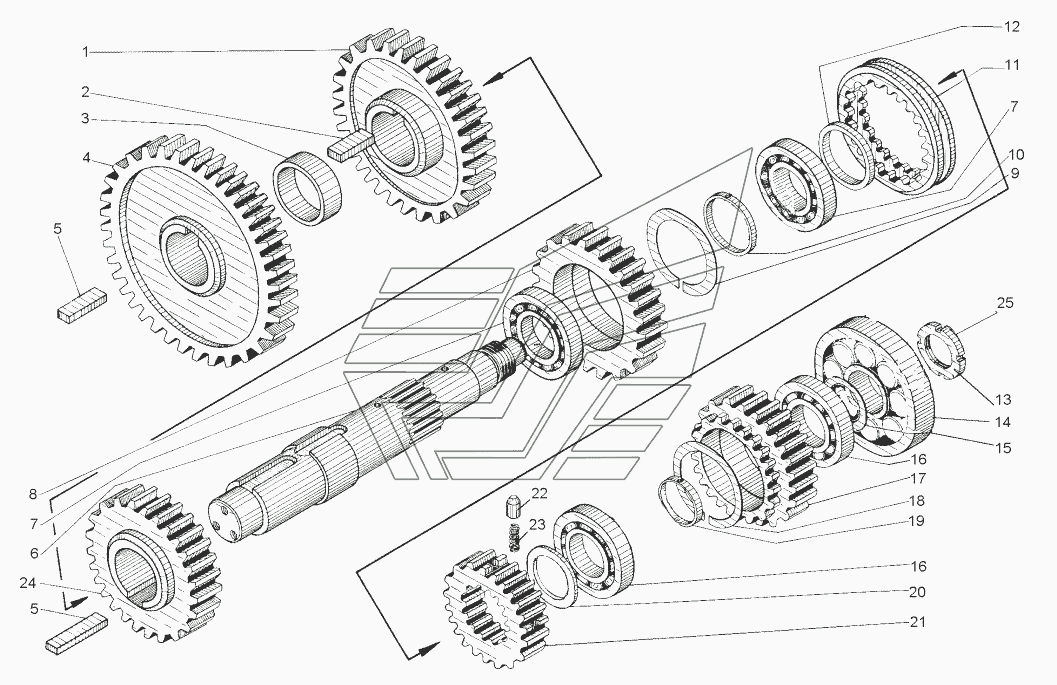 Кроме того, комбинированное лечение не смогло отменить повторный рост, а лишь задержало его в некоторых клеточных линиях. Мы предположили, что после лечения doxo может существовать дополнительное подмножество клеток, которое не зависит от интра-S- и/или G2/M-контрольных точек.Поэтому было исследовано наличие остановки митозов после лечения doxo. С помощью иммунофлуоресценции клетки окрашивали на экспрессию Ph4, специфически экспрессируемого в поздней G2/M-фазе с самыми высокими уровнями во время M-фазы [27].
Кроме того, комбинированное лечение не смогло отменить повторный рост, а лишь задержало его в некоторых клеточных линиях. Мы предположили, что после лечения doxo может существовать дополнительное подмножество клеток, которое не зависит от интра-S- и/или G2/M-контрольных точек.Поэтому было исследовано наличие остановки митозов после лечения doxo. С помощью иммунофлуоресценции клетки окрашивали на экспрессию Ph4, специфически экспрессируемого в поздней G2/M-фазе с самыми высокими уровнями во время M-фазы [27].
После обработки doxo во всех клеточных линиях, кроме Kelly, наблюдалось увеличение доли Ph4-положительных клеток (указывающее на остановку митоза). SK-N-FI и BE(2)-C продемонстрировали самую высокую долю клеток в состоянии остановки митоза после обработки doxo, достигнув 20% и 15% Ph4-положительных клеток соответственно.Кроме того, поведение клеточного цикла до доксо-индуцированной остановки митоза также исследовали путем совместного окрашивания с Ph4 и аналогом тимидина EdU, что указывает на активную репликацию / S-фазу прогрессирования во время лечения.
Таблица 4
Маркерный анализ после однократной обработки doxo в течение 48 часов.
| Ph4+ | EdU+ | Ph4+/EdU+ | Ph4+/EdU- | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Cell Line | Mock | Доксо | р | Макет | Доксо | р | Макет | Доксо | р | Макет | Доксо | р | ||||
| СК-Н-ДЗ | 3. 9 ± 1,4 9 ± 1,4 | < | 11 ± 2,1 | * | 98 ± 0,7 | > | 81 ± 3,2 | *** | 3,9 ± 1,4 | < | 7,7 ± 1,1 | * | 0,1 ± 0,1 | < | 2,9 ± 1,1 | * |
| Келли | 5,8 ± 2,0 | ≃ | 3,6 ± 0,5 | НР | 92 ± 8,1 | > | 20 ± 17 | ** | 5. 5 ± 2,3 5 ± 2,3 | > | 0,8 ± 0,8 | ** | 0,3 ± 0,3 | < | 2,7 ± 0,4 | * |
| СК-Н-АС | 1,2 ± 0,5 | < | 6,0 ± 2,4 | * | 93 ± 3,0 | > | 72 ± 6,3 | *** | 1,2 ± 0,6 | < | 4,7 ± 2,0 | * | 0,1 ± 0,1 | < | 1,3 ± 0,7 | * |
| СК-Н-ФИ | 4. 9 ± 1,8 9 ± 1,8 | < | 20 ± 5,0 | ** | 65 ± 14 | > | 27 ± 1,5 | ** | 3,8 ± 1,9 | < | 9,3 ± 2,8 | * | 1,1 ± 0,1 | < | 11 ± 2,2 | ** |
| BE(2)-C | 6,0 ± 1,6 | < | 15 ± 1,5 | **** | 98 ± 0,3 | > | 64 ± 9,1 | **** | 6. 0 ± 1,8 0 ± 1,8 | < | 9,3 ± 0,9 | ** | 0,0 ± 0,0 | < | 5,4 ± 0,9 | **** |
Значительное снижение EdU-позитивных клеток наблюдалось во всех протестированных клеточных линиях после воздействия 1 мкМ doxo, как и ожидалось при доксо-индуцированной остановке клеточного цикла. Наиболее резкое снижение EdU-позитивных клеток, свидетельствующее об обильной аресте, было отмечено для Kelly и SK-N-FI (с 92 до 20% и с 65 до 27% соответственно).Несмотря на статистически значимое снижение, SK-N-DZ, SK-N-AS и BE(2)-C сохраняли относительно высокие уровни, в диапазоне 64–81%, EdU-положительных клеток после лечения doxo.
Небольшое, но значимое увеличение количества клеток Ph4+/EdU+ (между 4,7–9,3%) было обнаружено в SK-N-DZ, SK-N-AS, SK-N-FI и BE(2)-C, но не у Келли, где было показано снижение до 0,8% клеток Ph4+/EdU+ и . Это указывало на то, что часть клеток была способна обходить внутри-S- и G2/M-контрольные точки с последующей остановкой митоза.
Развитие клеточного цикла в клетках BE(2)-C после обработки доксо. Клетки BE(2)-C, обработанные имитацией или доксо (1 мкМ). Клетки Ph4+/EdU+ присутствовали как в имитационных, так и в доксо-культурах. Стрелка: клетки Ph4+/EdU+. Масштабная линейка 50 мкм.
Кроме того, все протестированные клеточные линии показали увеличение числа клеток Ph4+/EdU-, что указывает на остановку митоза без предварительного прохождения через S-фазу.
Принимая во внимание многолетний клинический опыт усиленного противоопухолевого эффекта от повторной КТ, мы исследовали поведение клеточного цикла после повторной обработки доксо, когда 1 мкМ доксо добавляли на 48 часов с последующей сменой среды и второй дозой 1 мкМ доксо в сочетании с EdU еще на 48 часов.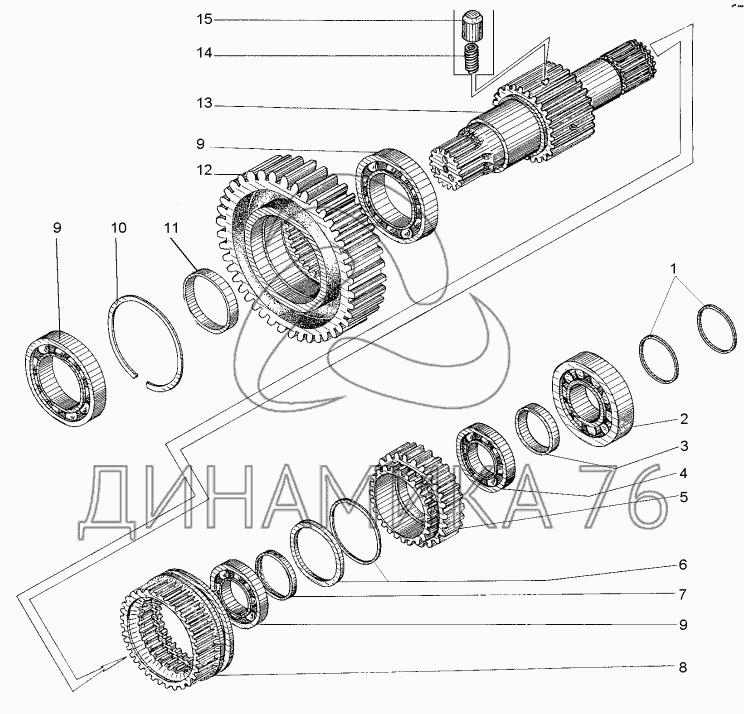
Во всех протестированных клеточных линиях после добавления doxo (1 + 1 мкМ) можно было показать, что устойчивые клетки в основном находятся в состоянии клеточного ареста, о чем свидетельствует либо повышенная экспрессия Ph4, либо отсутствие включения EdU. Тем не менее, относительные пропорции арестованных клеток различались среди клеточных линий: Kelly, SK-N-FI и BE(2)-C показали самую высокую долю клеток в митотической остановке и самую низкую долю EdU-положительных клеток.
Таблица 5
Маркерный анализ после повторной обработки doxo в течение 48 + 48 часов.
| Ph4+ | EdU+ | Ph4+/EdU+ | Ph4+/EdU- | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Клеточная линия | Mock | Доксо | р | Макет | Доксо | р | Макет | Доксо | р | Макет | Доксо | р | ||||
| СК-Н-ДЗ | 1. 8 ± 1,2 8 ± 1,2 | < | 7,8 ± 2,8 | * | 99 ± 0,4 | > | 14 ± 8,0 | **** | 1,8 ± 1,2 | ≃ | 0,8 ± 0,7 | НР | 0,0 ± 0,0 | < | 6,9 ± 2,1 | ** |
| Келли | 3,2 ± 0,7 | < | 24 ± 6,0 | ** | 98 ± 1,5 | > | 0. 0 ± 0,0 0 ± 0,0 | **** | 3,2 ± 0,7 | > | 0,0 ± 0,0 | ** | 0,0 ± 0,0 | < | 24 ± 6,0 | ** |
| СК-Н-АС | 3,7 ± 1,8 | ≃ | 4,6 ± 1,4 | НР | 97 ± 1,2 | > | 12 ± 2,0 | **** | 3,6 ± 1,8 | > | 1,2 ± 0,7 | * | 0. 1 ± 0,1 1 ± 0,1 | < | 3,5 ± 0,8 | *** |
| СК-Н-ФИ | 3,0 ± 0,1 | < | 15 ± 0,5 | *** | 76 ± 2,9 | > | 7,1 ± 3,2 | **** | 2,9 ± 0,2 | ≃ | 3,5 ± 1,2 | НР | 0,1 ± 0,1 | < | 11 ± 0,2 | **** |
| BE(2)-C | 8. 4 ± 4,7 4 ± 4,7 | < | 35 ± 4,8 | ** | 98 ± 0,4 | > | 5,5 ± 0,7 | **** | 8,4 ± 4,7 | ≃ | 1,3 ± 0,6 | НР | 0,0 ± 0,1 | < | 34 ± 4,2 | **** |
Кроме того, во всех клеточных линиях, кроме Kelly, была обнаружена небольшая доля клеток Ph4+/EdU+ (0,8–3,5%), что указывает на остановку митоза с предшествующим продвижением через S-фазу во время второй обработки doxo. Все протестированные клеточные линии также показали увеличение числа клеток Ph4+/EdU-, что указывает на остановку митоза без предварительного прохождения через S-фазу.
Все протестированные клеточные линии также показали увеличение числа клеток Ph4+/EdU-, что указывает на остановку митоза без предварительного прохождения через S-фазу.
Эти данные иллюстрируют наличие клеток в состоянии остановки митоза (Ph4-положительные) после однократной и повторной обработки доксо во всех тестируемых клеточных линиях. Более того, подмножество клеток, остановленных в митозе, может быть дополнительно подразделено в зависимости от их поведения в клеточном цикле, на что указывают клетки, проходящие или не проходящие через S-фазу до остановки.
2.6. Дальнейшие исследования рецидива и образования колоний после обработки Doxo
Чтобы исследовать последствия репликации клеток во время обработки, мы импульсно пометили EdU во время однократной обработки doxo 1 мкМ и исследовали способность к повторному росту (колоний). Были отобраны три клеточные линии, Kelly, SK-N-FI и BE(2)-C, поскольку они демонстрировали ряд характеристик клеточного цикла после обработки doxo, при этом Kelly преимущественно накапливалась в S-фазе и имела низкую долю EdU.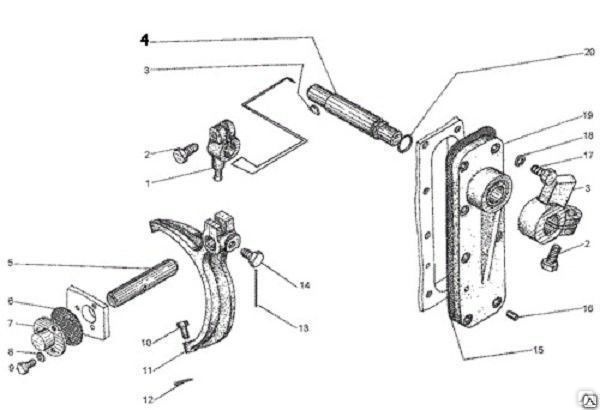 положительные клетки (20%), тогда как SK-N-FI показал накопление как в S-, так и в G2/M-фазе и имел низкую долю EdU-положительных клеток (27%), а BE(2)-C показал накопление в G2/ M-фаза и имела более высокую долю EdU-положительных клеток (64%) и таблицу S3.
положительные клетки (20%), тогда как SK-N-FI показал накопление как в S-, так и в G2/M-фазе и имел низкую долю EdU-положительных клеток (27%), а BE(2)-C показал накопление в G2/ M-фаза и имела более высокую долю EdU-положительных клеток (64%) и таблицу S3.
В клеточной линии Kelly EdU-положительные клетки сохранялись в 2/45 вновь образованных колониях, в SK-N-FI EdU-положительные клетки сохранялись в 12/36 вновь образованных колониях, а в BE(2)-C EdU-положительные клетки сохранялись в 37/40 новообразованных колоний. Помимо обнаружения EdU-положительных клеток в колониях, была также фракция EdU-положительных клеток, не примыкающих непосредственно к колониям. Эти клетки насчитывали в среднем на одно покровное стекло 5 ± 4 EdU-положительных клеток для Келли, 17 ± 8 EdU-положительных клеток для SK-N-FI и 23 ± 9 EdU-положительных клеток для BE(2)-C.Количество оставшихся EdU-позитивных клеток было ниже у Келли по сравнению с BE(2)-C ( p < 0,05, N = 3, тест Стьюдента t -тест), но не по сравнению с SK-N-FI ( p > 0,05, N = 3, Стьюдента ( t -критерий). Последствия этих EdU-положительных клеток еще предстоит исследовать.
Последствия этих EdU-положительных клеток еще предстоит исследовать.
EdU-положительные клетки BE(2)-C в состоянии возобновления роста после однократной обработки doxo. Клетки BE(2)-C обрабатывали доксо (1 мкМ) в сочетании с EdU. Для определения колонии, расположенной справа, был установлен порог >10 клеток в непосредственной близости.EdU-положительные клетки присутствовали, не примыкая непосредственно к отросшей колонии. Стрелка: EdU-положительная клетка. Увеличение положительной клетки EdU показано слева. Масштабная линейка 50 мкм.
В совокупности результаты указывают на гетерогенность среди клеточных линий NB в отношении доли отрастающих колоний с потомками опухолевых клеток, завершивших репликацию во время заражения doxo.
На основании наших выводов и в связи с наличием наибольшей доли EdU-положительных колоний клеточная линия BE(2)-C была выбрана для дополнительного отслеживания повторного роста с использованием EdU в сочетании с повторной обработкой doxo (1 + 1 мкМ).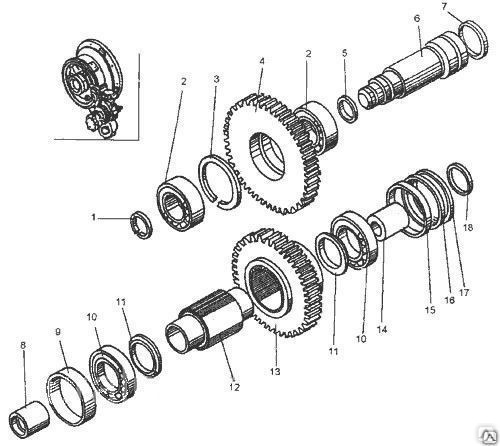 Клетки BE(2)-C метили импульсным способом EdU во время введения второй дозы doxo, и колонии исследовали на наличие EdU-положительных клеток. Однако в 63/63 идентифицированных колониях не было обнаружено EdU-положительных клеток. Это говорит о том, что клетки, ответственные за повторный рост после повторных обработок доксо, не прошли через S-фазу, по крайней мере, во время второй дозы доксо.
Клетки BE(2)-C метили импульсным способом EdU во время введения второй дозы doxo, и колонии исследовали на наличие EdU-положительных клеток. Однако в 63/63 идентифицированных колониях не было обнаружено EdU-положительных клеток. Это говорит о том, что клетки, ответственные за повторный рост после повторных обработок доксо, не прошли через S-фазу, по крайней мере, во время второй дозы доксо.
На самом деле, исследование фракции клеток BE(2)-C, положительных по белкам контрольных точек клеточного цикла, после многократного doxo Таблица S4 показала высокую долю клеток, положительных по pATM (1.от 3 до 90%, p < 0,001), аналогично тому, что было обнаружено после однократного лечения доксо. Фракция pCHK1 или pCHK2-положительных клеток была снижена, достигая уровней, сходных с имитацией лечения. Однако наблюдалось стойкое увеличение доли клеток, положительных по Wee1 (от 8,4 до 17%; p <0,01) и p21 (от 1,7 до 39%; p <0,001), что подтверждает идею об устойчивой активации контрольной точки. . Кроме того, также наблюдалось увеличение доли клеток, экспрессирующих p27 Kip1 (0.от 0 до 2,8%, p <0,01), что указывает на то, что подгруппа клеток была остановлена в течение длительного периода времени.
. Кроме того, также наблюдалось увеличение доли клеток, экспрессирующих p27 Kip1 (0.от 0 до 2,8%, p <0,01), что указывает на то, что подгруппа клеток была остановлена в течение длительного периода времени.
Эти данные показывают, что прогрессирование клеток через S-фазу во время однократного лечения doxo способно к повторному росту. Однако это не тот случай, когда doxo вводят повторно. Вместо этого клетки, которые, скорее всего, уже были арестованы после первой обработки doxo, способны к повторному росту.
3. Обсуждение
Проблема опухолей крайне высокого риска и рецидивов остается основным препятствием на пути успешного лечения НБ.Активация контрольных точек клеточного цикла после терапии была связана с выживаемостью опухолевых клеток, и хотя использование этих контрольных точек было успешной стратегией лечения нескольких опухолей у взрослых [28], потенциал их использования при лечении опухолей у детей был изучен лишь недавно.
В данном случае активация контрольной точки клеточного цикла после обработки doxo была исследована на панели из пяти клеточных линий сверхвысокого риска in vitro TP53 mut NB. Данные проточной цитометрии показали для всех клеточных линий высокую, но не полную устойчивость к доксо-индуцированному апоптозу, что согласуется с предыдущей литературой и предполагаемой ролью p53 в индукции гибели клеток [11].Кроме того, дозозависимое уменьшение количества клеток в G0/G1 (2N-фракция) и накопление в S- и/или G2/M-фазе наблюдалось во всех клеточных линиях после 0,1 или 1 мкМ doxo, что согласуется с мнение, что клетки с дисфункциональным путем p53 обычно не могут останавливаться в контрольной точке G1/S [29,30]. Однако клеточный ответ зависел от дозы, например, две клеточные линии, SK-N-AS и Kelly, которые демонстрировали предпочтительное накопление в S-фазе после введения 1 мкМ doxo, вместо этого имели предпочтительное накопление в G2/M-фазе после введения 1 мкМ doxo. 0.1 мкМ доксо. Это указывает на то, что ответ зависит от степени повреждения ДНК. Эти результаты подтверждают влияние различных концентраций лекарственного средства на контрольные точки клеточного цикла, особенно потому, что опухолевые клетки могут подвергаться нелетальным дозам из-за неизбежного быстрого снижения концентрации лекарственного средства [9], что приводит к созданию нескольких различных субпопуляций, устойчивых к ХТ, на которые необходимо воздействовать по-разному.
Данные проточной цитометрии показали для всех клеточных линий высокую, но не полную устойчивость к доксо-индуцированному апоптозу, что согласуется с предыдущей литературой и предполагаемой ролью p53 в индукции гибели клеток [11].Кроме того, дозозависимое уменьшение количества клеток в G0/G1 (2N-фракция) и накопление в S- и/или G2/M-фазе наблюдалось во всех клеточных линиях после 0,1 или 1 мкМ doxo, что согласуется с мнение, что клетки с дисфункциональным путем p53 обычно не могут останавливаться в контрольной точке G1/S [29,30]. Однако клеточный ответ зависел от дозы, например, две клеточные линии, SK-N-AS и Kelly, которые демонстрировали предпочтительное накопление в S-фазе после введения 1 мкМ doxo, вместо этого имели предпочтительное накопление в G2/M-фазе после введения 1 мкМ doxo. 0.1 мкМ доксо. Это указывает на то, что ответ зависит от степени повреждения ДНК. Эти результаты подтверждают влияние различных концентраций лекарственного средства на контрольные точки клеточного цикла, особенно потому, что опухолевые клетки могут подвергаться нелетальным дозам из-за неизбежного быстрого снижения концентрации лекарственного средства [9], что приводит к созданию нескольких различных субпопуляций, устойчивых к ХТ, на которые необходимо воздействовать по-разному.
Среди распространенных генетических изменений в NB амплификация MYCN способствует пролиферации, но также активирует транскрипцию CHK1 [31].Три из протестированных клеточных линий, SK-N-DZ, Kelly и BE(2)-C, содержат амплификацию MYCN , и две из них активировали CHK1 после обработки doxo, тогда как только BE(2)-C показала снижение роста после комбинированного лечения с CHK1i. Более того, клетки BE(2)-C также реагировали задержкой роста после комбинированного лечения Wee1i и p21i, что согласуется с активной контрольной точкой G2/M. С другой стороны, SK-N-DZ, который после обработки doxo показал самую высокую долю клеток, экспрессирующих pATM (89%), среди протестированных клеточных линий, показал задержку роста после комбинированного лечения с ATMi, что указывает на его чувствительность.Синтетическая летальность была предложена между ингибиторами CHK1 и ATM, поэтому эта комбинация может быть альтернативой в MYCN -амплифицированных клетках NB [32].
Кроме того, клеточная линия SK-N-AS, в которой имеется потеря одной копии 11q, приводящая к нарушению функциональных возможностей ATM и CHK1 из-за гаплонедостаточности [33], показала увеличение экспрессирующих p21 клеток после обработки doxo. Фактически было показано, что p21 действует как супрессор репликации в скоординированной регуляторной сети, которая управляется поли-АДФ-рибозополимеразой 1 (PARP1) [34].Более того, PARP способен отслеживать вилки репликации после повреждения ДНК во время S-фазы, тем самым облегчая активацию контрольных точек внутри S-фазы [35]. Это согласуется с нашими результатами, показывающими предпочтение накопления S-фазы после обработки doxo в клеточной линии A SK-N-AS. При АС необходимо дополнительно изучить вопрос о добавлении ингибиторов PARP, отдельно или в комбинации с ингибиторами p21, к ХТ второй линии в этой группе риска [36].
Фактически было показано, что p21 действует как супрессор репликации в скоординированной регуляторной сети, которая управляется поли-АДФ-рибозополимеразой 1 (PARP1) [34].Более того, PARP способен отслеживать вилки репликации после повреждения ДНК во время S-фазы, тем самым облегчая активацию контрольных точек внутри S-фазы [35]. Это согласуется с нашими результатами, показывающими предпочтение накопления S-фазы после обработки doxo в клеточной линии A SK-N-AS. При АС необходимо дополнительно изучить вопрос о добавлении ингибиторов PARP, отдельно или в комбинации с ингибиторами p21, к ХТ второй линии в этой группе риска [36].
Более того, при использовании одноклеточного подхода мы смогли обнаружить гетерогенность в эндогенной экспрессии белков контрольных точек клеточного цикла среди различных клеточных линий NB. И Kelly, и SK-N-FI продемонстрировали высокую долю клеток, экспрессирующих p21 (18% и 23%, соответственно), в образцах, обработанных имитации, оба также показали повышенное накопление S-фазы и небольшое количество EdU-положительных клеток (20% и 27%). % соответственно) после лечения доксо. Это поведение клеточного цикла может быть связано с независимой от р53 экспрессией р21, поскольку эндогенная экспрессия р21 связана с поведением клеточного цикла с высокой экспрессией, приводящей к судьбе старения [37].Кроме того, Келли показал задержку роста после совместного ингибирования p21i и doxo, вероятно, из-за эндогенной высокой экспрессии p21, что указывает на роль p21 в регуляции ответа doxo. Клеточная линия SK-N-FI показала только начальное снижение роста, которое не сохранялось после комбинированного лечения с Wee1i.
% соответственно) после лечения доксо. Это поведение клеточного цикла может быть связано с независимой от р53 экспрессией р21, поскольку эндогенная экспрессия р21 связана с поведением клеточного цикла с высокой экспрессией, приводящей к судьбе старения [37].Кроме того, Келли показал задержку роста после совместного ингибирования p21i и doxo, вероятно, из-за эндогенной высокой экспрессии p21, что указывает на роль p21 в регуляции ответа doxo. Клеточная линия SK-N-FI показала только начальное снижение роста, которое не сохранялось после комбинированного лечения с Wee1i.
Наши результаты, несмотря на то, что они иллюстрируют гетерогенный ответ среди клеточных линий NB, обобщенный в Таблице S5, согласуются с другими исследованиями, в которых комбинированное лечение ингибиторами белков контрольных точек клеточного цикла и СТ сенсибилизирует опухолевые клетки, что приводит к уменьшению, но не устранению , клеточного роста [32,38,39].Это также предполагает наличие подмножества арестованных клеток, которые чувствительны к химическим ингибиторам белков интра-S и/или G2/M-контрольных точек. Однако многие клинические испытания белков контрольных точек были прекращены из-за токсичности и/или низкой специфичности мишени [28]. Одним из объяснений может быть то, что ответ на повреждение ДНК представляет собой хорошо организованную сеть, которая может сделать клетки относительно нечувствительными к антипролиферативному эффекту одного ингибитора белка контрольной точки клеточного цикла [40].Поэтому было предложено использовать комбинацию этих агентов для повышения эффективности традиционной ХТ [28]. Тем не менее нельзя исключать вклад дополнительных доксорезистентных субпопуляций, и поэтому мы предлагаем альтернативную или дополнительную интерпретацию, предполагающую существование резистентных опухолевых клеток, не зависящих от интра-S- и/или G2/M-контрольных точек. Мечение митотическим маркером Ph4 выявило увеличение Ph4-позитивных клеток (митотическая остановка) для всех клеточных линий после однократной или повторной обработки doxo и .Недавние исследования предоставили доказательства важности остановки митотозов как при формировании, так и при лечении опухолей, когда аномалии в митотическом процессе могут способствовать усилению анеуплоидии, полиплоидии и структурным повреждениям ДНК [41].
Однако многие клинические испытания белков контрольных точек были прекращены из-за токсичности и/или низкой специфичности мишени [28]. Одним из объяснений может быть то, что ответ на повреждение ДНК представляет собой хорошо организованную сеть, которая может сделать клетки относительно нечувствительными к антипролиферативному эффекту одного ингибитора белка контрольной точки клеточного цикла [40].Поэтому было предложено использовать комбинацию этих агентов для повышения эффективности традиционной ХТ [28]. Тем не менее нельзя исключать вклад дополнительных доксорезистентных субпопуляций, и поэтому мы предлагаем альтернативную или дополнительную интерпретацию, предполагающую существование резистентных опухолевых клеток, не зависящих от интра-S- и/или G2/M-контрольных точек. Мечение митотическим маркером Ph4 выявило увеличение Ph4-позитивных клеток (митотическая остановка) для всех клеточных линий после однократной или повторной обработки doxo и .Недавние исследования предоставили доказательства важности остановки митотозов как при формировании, так и при лечении опухолей, когда аномалии в митотическом процессе могут способствовать усилению анеуплоидии, полиплоидии и структурным повреждениям ДНК [41].
Кроме того, совместное мечение с Ph4 и EdU показало, что подмножество клеток в митотической остановке прогрессировало через S-фазу во время однократной обработки doxo. Эти клетки, по-видимому, обходят внутри-S- и G2/M-контрольные точки, явление, известное как адаптация контрольных точек [42].Хотя большинство клеток, которые проходят адаптацию контрольных точек, погибают, было показано, что небольшое количество клеток выживает [43,44]. Наши данные показали, что часть новообразованных колоний в клетках Kelly (4%), SK-N-FI (33%) и BE(2)-C (92%) включает потомков клеток, активно реплицирующихся в течение 48-часового окна. doxo обработка, т. е. клетки, проходящие S-фазу, что указывает на клеточный источник повторного роста. Однако необходимы дальнейшие исследования, чтобы уточнить пропорции активно реплицирующихся (EdU-положительных) клеток, которые могут пройти адаптацию контрольных точек после лечения.Интересно, что было предположено, что ATM синергизирует с p21 для ингибирования активности Cdk2 в клетках, адаптирующихся к контрольным точкам, которые затем запрограммированы на переход в состояние покоя [45]. Наши результаты согласуются с этим явлением, поскольку наблюдалось снижение количества реплицирующихся (EdU-положительных) клеток и увеличение доли клеток, положительных по pATM, p21 и p27 Kip1 в клеточной линии BE(2)-C после повторное лечение doxo, указывающее на сохраняющуюся остановку и/или покой.
Наши результаты согласуются с этим явлением, поскольку наблюдалось снижение количества реплицирующихся (EdU-положительных) клеток и увеличение доли клеток, положительных по pATM, p21 и p27 Kip1 в клеточной линии BE(2)-C после повторное лечение doxo, указывающее на сохраняющуюся остановку и/или покой.
Наличие подмножества резистентных клеток, способных активно размножаться во время лечения, усложняет процесс сенсибилизации опухолевых клеток к препаратам, повреждающим ДНК.Одно альтернативное лечение было получено в результате исследования, в котором ингибитор CHK1/2 показал сильную синергию с антиметаболитом гемцитабином, который нацелен на прогрессирование опухолевых клеток в S-фазе [24]. Также стоит отметить, что добавление слабого антиметаболита EdU в сочетании с доксо в BE(2)-C приводило к снижению числа новообразованных колоний на 10-е сутки с 8,3 ± 1,5 до 1,0 ± 1,0 по сравнению с однократное лечение doxo (данные не показаны). Это указывает на особую уязвимость к антиметаболитам в сочетании с обработкой doxo в клеточных линиях NB. Аналогичное открытие было ранее сообщено, когда EdU обладал антипролиферативным эффектом, не будучи явно цитотоксическим [46]. Следовательно, альтернативное комбинированное лечение антиметаболитами, по крайней мере, в течение первых нескольких раундов терапии, может быть многообещающим вариантом лечения в протоколах терапии при крайне высоком риске и после рецидива НБ, где мутации TP53 встречаются чаще. Кроме того, эти результаты in vitro могут повлиять на разработку новых стратегий лечения благодаря тому, что doxo сегодня обычно включается в протоколы терапии первой линии и терапии спасения.
Аналогичное открытие было ранее сообщено, когда EdU обладал антипролиферативным эффектом, не будучи явно цитотоксическим [46]. Следовательно, альтернативное комбинированное лечение антиметаболитами, по крайней мере, в течение первых нескольких раундов терапии, может быть многообещающим вариантом лечения в протоколах терапии при крайне высоком риске и после рецидива НБ, где мутации TP53 встречаются чаще. Кроме того, эти результаты in vitro могут повлиять на разработку новых стратегий лечения благодаря тому, что doxo сегодня обычно включается в протоколы терапии первой линии и терапии спасения.
4. Материалы и методы
4.1. Клеточные линии и культура
BE(2)-C и Kelly были получены от ATCC (Манассас, Вирджиния, США). SK-N-AS, SK-N-FI и SK-N-DZ были любезным подарком профессора Пера Когнера из Каролинского института. STR-анализ (Eurofins Genomics, Эберсберг, Германия) подтвердил подлинность клеточных линий (данные не показаны). Основные характеристики клеточных линий NB описаны в таблице S1 [31,33,47]. Клетки культивировали в среде RPMI 1640 с добавлением 10% фетальной бычьей сыворотки, 2 мМ L-глутамина и 1% пенициллина/стрептомицина (все от Life Technologies Inc, Thermo Fisher Scientific, Стокгольм, Швеция), при 37 °C, 5% CO 2 при повышенной влажности.
Клетки культивировали в среде RPMI 1640 с добавлением 10% фетальной бычьей сыворотки, 2 мМ L-глутамина и 1% пенициллина/стрептомицина (все от Life Technologies Inc, Thermo Fisher Scientific, Стокгольм, Швеция), при 37 °C, 5% CO 2 при повышенной влажности.
4.2. Обработка доксорубицином
Доксорубицин (doxo) (Apoteket AB, Стокгольм, Швеция) разводили в 1X PBS и вводили в культуральную среду. Доксо добавляли на 48 ч в концентрациях 0,01 мкМ, 0,1 мкМ или 1 мкМ к клеткам в логарифмическом росте. Для повторной (1 + 1 мкМ) обработки doxo добавляли 1 мкМ doxo на 48 часов с последующей заменой среды и второй дозой 1 мкМ doxo еще на 48 часов. Для имитации лечения в культуральную среду добавляли 1X PBS.
4.3. Проточная цитометрия
Все пять клеточных линий NB при логарифмическом росте обрабатывали имитацией (1X PBS) или 0.01 мкМ, 0,1 мкМ, 1 мкМ доксо. Через 48 часов после обработки клетки фиксировали 70% EtOH перед инкубацией с Hoechst 33343 (Applied Biosystems, Thermo Fisher Scientific, Стокгольм, Швеция) в соответствии с протоколом производителя и анализировали на FACS Novocyte ® (Agilent, Санта-Клаус). Клара, Калифорния, США). Данные были проанализированы и количественно оценены с использованием программного обеспечения NovoExpress TM (версия 1.4, Agilent, Санта-Клара, Калифорния, США). Каждое условие выполнялось трижды. Статистические данные были выполнены по доле клеток в пределах конкретных ворот.
Клара, Калифорния, США). Данные были проанализированы и количественно оценены с использованием программного обеспечения NovoExpress TM (версия 1.4, Agilent, Санта-Клара, Калифорния, США). Каждое условие выполнялось трижды. Статистические данные были выполнены по доле клеток в пределах конкретных ворот.
4.4. Иммунофлуоресценция
После фиксации в течение 15 минут в охлажденном льдом свежеприготовленном 4% параформальдегиде (Merck, Molsheim, Франция) клетки инкубировали в буфере TNB: 0,5 г блокирующего реагента (PerkinElmer, Стокгольм, Швеция) в 100 мл буфера TBS ( Трис/NaCl pH 7,4) в течение 30 мин при комнатной температуре. Затем клетки инкубировали с 1’ab, разведенным в 0,3% Triton X-100, 0,1% NaN 3 в 1X PBS в течение ночи при +4 °C. После промывки клетки инкубировали с 2’ab, разведенным в буфере TNB, в течение 2 ч при комнатной температуре.Клетки промывали и заливали антифейдом Prolong Gold с DAPI (Thermo Fisher Scientific, Стокгольм, Швеция) для визуализации ядер. Окрашенные клетки анализировали с использованием платформы для сканирования слайдов Metafer ® (версия 3.13.4, Metasystems, Гейдельберг, Германия). Список используемых антител и наборов представлен в таблице S2.
Окрашенные клетки анализировали с использованием платформы для сканирования слайдов Metafer ® (версия 3.13.4, Metasystems, Гейдельберг, Германия). Список используемых антител и наборов представлен в таблице S2.
4.5. Титрование и анализ MTS
Клетки в логарифмическом росте обрабатывали серией титрования от 10 до 0,01 мкМ ингибитора АТМ (ATMi) (KU 60019, Tocris, Бристоль, Великобритания), ингибитора CHK1 (CHK1i) (PF-477736, Merck , Мольсхайм, Франция), ингибитор CHK1/2 (CHK1/2i) (AZD-7762, Merck, Molsheim, Франция), Wee1 (Wee1i) (Adavosertib, MedChemTronica, Стокгольм, Швеция) или p21 (p21i) (UC2288, Merck , Мольсхайм, Франция), разбавленный диметилсульфоксидом (ДМСО).Через 72 часа был проведен анализ 3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2H-тетразолия (MTS), где 20 мкл CellTiter 96 ® AQueous One Solution Assay (Promega, Стокгольм, Швеция) добавляли на 100 мкл среды. Затем планшеты инкубировали в течение 3 ч и анализировали в устройстве для чтения микропланшетов FLUOstar Omega (BMG LABTECH, Ортенберг, Германия). Поглощение при 490 нм и 690 нм измеряли для оценки жизнеспособности клеток после обработки. Каждую обработку проводили в трехкратной повторности.В качестве отрицательного контроля использовали ДМСО.
Поглощение при 490 нм и 690 нм измеряли для оценки жизнеспособности клеток после обработки. Каждую обработку проводили в трехкратной повторности.В качестве отрицательного контроля использовали ДМСО.
4.6. Анализ слияния
Каждую клеточную линию при логарифмическом росте обрабатывали концентрацией 10 мкМ для ATMi и p21i или соответствующим значением IC50 для каждого лекарственного средства. Соответствующие препараты либо в виде одного агента ATMi, CHK1i, CHK1/2i, Wee1i, p21i, либо в комбинации с 1 мкМ doxo добавляли на 48 ч с последующей сменой среды. В качестве отрицательного контроля использовали доксо в количестве 1 мкМ, 1X PBS (имитация) или ДМСО (имитация). Планшеты сканировали с помощью системы анализа клеток IncuCyte S3 Live ® (Essen Bioscience, Welwyn Garden City, UK) каждые 48 часов в течение 44 дней.Свежую среду добавляли каждые 4 дня. Пролиферацию определяли путем измерения слияния клеток. Каждую обработку проводили в пяти повторах, и данные представлены как среднее ± стандартная ошибка среднего (SEM).
4.7. 5-Этинил-2′-дезоксиуридин
Аналог тимидина 5-этинил-2′-дезоксиуридин (EdU) (Applied Biosystems, Thermo Fisher Scientific, Стокгольм, Швеция) добавляли в концентрации 10 мкМ за 48 ч до фиксации. Маркировку EdU проводили в соответствии с протоколом производителя.
4.8. Формирование колоний
Клетки Kelly, SK-N-FI и BE(2)-C при логарифмическом росте обрабатывали 1 мкМ doxo в сочетании с 10 мкМ EdU в течение 48 часов с последующей сменой среды. Клеткам давали расти, добавляя свежую среду каждые 4 дня, пока не стали видны колонии. Клетки фиксировали в течение 15 мин в охлажденном льдом свежеприготовленном 4% параформальдегиде, мечение EdU проводили согласно протоколу производителя. Плотность клеток визуализировали с помощью окрашивания DAPI, а количество EdU-положительных клеток расшифровывали как количество клеток на отсканированное изображение (10-кратное изображение) с использованием платформы для сканирования слайдов Metafer ® .Образование колоний с порогом >10 клеток в непосредственной близости, установленным для определения колонии, оценивали путем визуального осмотра.
4.9. Статистический анализ
Данные анализировали с использованием теста Стьюдента t и двустороннего дисперсионного анализа (ANOVA). Апостериорный критерий Даннета или Бонферрони был применен для корректировки множественного тестирования, как указано в тексте. Программное обеспечение GraphPad Prism 7.03 (Сан-Диего, Калифорния, США) использовалось для тестирования нормального распределения и построения графиков.Данные иммунофлуоресценции анализировали в программе RStudio (версия 1.2.5033, Бостон, Массачусетс, США) и для каждой комбинации рассчитывали процент положительных клеток с последующим средним значением ± стандартное отклонение (SD).
Вклад авторов
Концептуализация, Л.А.-Р. и SSF; Курирование данных, SSF; Формальный анализ, L.Ö.J., MS, XL-L., F.L.K. и SSF; Привлечение финансирования, L.Ä.-R. и SSF; Расследование, L.Ö.J., MS, XL-L., F.L.K. и SSF; Методология, SSF; Администрация проекта, Н.Х. и С.С.Ф.; Ресурсы, Л.Э.-Р. и SSF; Программное обеспечение, SSF; Надзор, Л.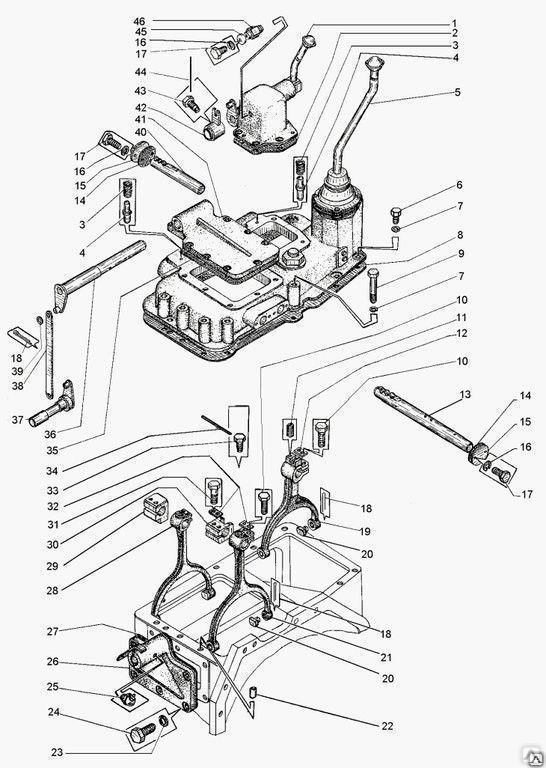 Э.-Р. и SSF; Валидация, L.Ö.J., MS, XL-L., F.L.K., L.Ä.-R. и SSF; Визуализация, SSF; Написание – первоначальный вариант, ONK, NH, L.Ä.-R. и SSF; Написание – обзор и редактирование, NH и SSF Все авторы прочитали и согласились с опубликованной версией рукописи.
Э.-Р. и SSF; Валидация, L.Ö.J., MS, XL-L., F.L.K., L.Ä.-R. и SSF; Визуализация, SSF; Написание – первоначальный вариант, ONK, NH, L.Ä.-R. и SSF; Написание – обзор и редактирование, NH и SSF Все авторы прочитали и согласились с опубликованной версией рукописи.
Границы | Ингибиторы контрольных точек и терапевтические вакцины для лечения хронической инфекции ВГВ
Введение
Инфекция вируса гепатита В (ВГВ) является огромным бременем для глобального здравоохранения.Несмотря на наличие эффективной профилактической вакцины, более 250 миллионов человек хронически инфицированы (1). Хроническая инфекция способствует развитию фиброза, цирроза и гепатоцеллюлярной карциномы, ежегодно приводя к примерно 887 000 смертей (1, 2). Большинству пациентов требуется пожизненное лечение аналогами нуклеоз(т)идов (НА), поскольку терапия не является лечебной, а просто подавляет репликацию вируса. Однако лечение NA высокоэффективно, уменьшает воспаление печени и имеет хороший профиль безопасности. Тем не менее, лечение не устраняет риск гепатоцеллюлярной карциномы; и отказ от лечения может вызвать рецидив вируса и тяжелое воспаление печени. Длительная терапия также редко приводит к функциональному излечению от хронической инфекции, что определяется клиренсом поверхностного антигена гепатита В (HBsAg) и неопределяемой вирусной нагрузкой в сыворотке. Таким образом, существует острая необходимость в разработке новых и более эффективных терапевтических средств.
Тем не менее, лечение не устраняет риск гепатоцеллюлярной карциномы; и отказ от лечения может вызвать рецидив вируса и тяжелое воспаление печени. Длительная терапия также редко приводит к функциональному излечению от хронической инфекции, что определяется клиренсом поверхностного антигена гепатита В (HBsAg) и неопределяемой вирусной нагрузкой в сыворотке. Таким образом, существует острая необходимость в разработке новых и более эффективных терапевтических средств.
HBV представляет собой небольшой оболочечный ДНК-вирус, принадлежащий к семейству Hepadnaviridae .Вирус имеет отчетливый тропизм к гепатоцитам, в которых он генерирует ковалентно замкнутую кольцевую (ccc) матрицу ДНК для производства новых вирионов и способен интегрироваться в геном хозяина (рис. 1) (3). Персистентность вирусного генома представляет собой основное препятствие, препятствующее стерилизующему излечению хронической инфекции ВГВ. Остается неясным, можно ли и каким образом этот транскрипционный шаблон полностью удалить из всех гепатоцитов. Кроме того, транскрипция ДНК ВГВ либо из кзкДНК, либо из интегрированной ДНК ВГВ приводит к секреции большого количества вирусного антигена, преимущественно HBsAg (рис. 1) (4), который, как считается, препятствует эффективному противовирусному иммунному ответу.Тем не менее, постоянное сдерживание репликации HBV может быть достигнуто, поскольку клиренс HBsAg редко происходит после хронической инфекции и легко наблюдается после острой инфекции у взрослых. Центральное место в разрешении вируса занимают HBV-специфические Т-клетки, которые повреждаются при хронической инфекции (5). Восстановление Т-клеточного иммунитета с помощью иммуномодуляции стало областью активных исследований, при этом несколько иммуномодулирующих стратегий изучаются в доклинических и клинических исследованиях.Конечной целью иммунотерапии ВГВ является индукция устойчивой потери транскрипции HBsAg при сохранении кзкДНК в гепатоцитах. Это состояние отражает то, что наблюдается у взрослых после острой инфекции ВГВ (6). Исчезновение HBsAg не только позволяет хроническим пациентам прекратить терапию, но также связано с более низким риском гепатоцеллюлярной карциномы, особенно если сероконверсия HBs происходит в возрасте до 50 лет (7, 8).
Кроме того, транскрипция ДНК ВГВ либо из кзкДНК, либо из интегрированной ДНК ВГВ приводит к секреции большого количества вирусного антигена, преимущественно HBsAg (рис. 1) (4), который, как считается, препятствует эффективному противовирусному иммунному ответу.Тем не менее, постоянное сдерживание репликации HBV может быть достигнуто, поскольку клиренс HBsAg редко происходит после хронической инфекции и легко наблюдается после острой инфекции у взрослых. Центральное место в разрешении вируса занимают HBV-специфические Т-клетки, которые повреждаются при хронической инфекции (5). Восстановление Т-клеточного иммунитета с помощью иммуномодуляции стало областью активных исследований, при этом несколько иммуномодулирующих стратегий изучаются в доклинических и клинических исследованиях.Конечной целью иммунотерапии ВГВ является индукция устойчивой потери транскрипции HBsAg при сохранении кзкДНК в гепатоцитах. Это состояние отражает то, что наблюдается у взрослых после острой инфекции ВГВ (6). Исчезновение HBsAg не только позволяет хроническим пациентам прекратить терапию, но также связано с более низким риском гепатоцеллюлярной карциномы, особенно если сероконверсия HBs происходит в возрасте до 50 лет (7, 8).
Рисунок 1 . Схематическое изображение хронической HBV-инфицированной печени.HBV сохраняется в виде ковалентно замкнутой кольцевой (ccc) ДНК в ядрах гепатоцитов и интегрируется в геном хозяина. Интегрированная и эписомальная ДНК HBV способствует постоянной секреции вирусных антигенов, в частности HBsAg. HBV-специфические Т-клетки нацелены на гепатоциты, инфицированные HBV, посредством секреции цитокинов и цитолитических молекул. Коровые и полимеразо-специфические Т-клетки функционально различны. Оболочечно-специфические Т-клетки обычно отсутствуют при хронической инфекции ВГВ, а при уже существующем количестве HBsAg эти клетки могут быть менее подходящей мишенью для иммунотерапии.Перечислены аспекты, которые необходимо учитывать при разработке и мониторинге иммунотерапии ВГВ.
Иммунотерапия ВГВ направлена на подавление репликации ВГВ в долгосрочной перспективе путем активизации иммунного ответа хозяина. Иммунотерапия может быть нацелена на врожденный и адаптивный иммунитет. Врожденные стратегии включают те, которые активируют рецепторы распознавания образов, такие как толл-подобные рецепторы и ген I, индуцируемый ретиноевой кислотой (RIG-I), полагаются на цитокины, направленные на HBV-инфицированные гепатоциты, или активируют NK-клетки. Адаптивные стратегии состоят из терапий, которые восстанавливают Т-клетки и антитела, включая перенаправленные Т-клетки Т-клеточного рецептора (TCR), Т-клетки химерного антигенного рецептора (CAR) и биспецифические растворимые TCR; ингибиторы контрольных точек и терапевтические вакцины.В этом обзоре мы уделяем особое внимание ингибиторам контрольных точек и терапевтическим вакцинам, поскольку они способны усиливать как Т-, так и В-клеточный иммунитет. Однако изучаются и другие стратегии, такие как снижение секреции HBsAg из инфицированных гепатоцитов путем блокирования транскрипции мРНК с использованием малых интерферирующих РНК (миРНК), которые подавляют экспрессию специфических вирусных транскриптов (9, 10).
Врожденные стратегии включают те, которые активируют рецепторы распознавания образов, такие как толл-подобные рецепторы и ген I, индуцируемый ретиноевой кислотой (RIG-I), полагаются на цитокины, направленные на HBV-инфицированные гепатоциты, или активируют NK-клетки. Адаптивные стратегии состоят из терапий, которые восстанавливают Т-клетки и антитела, включая перенаправленные Т-клетки Т-клеточного рецептора (TCR), Т-клетки химерного антигенного рецептора (CAR) и биспецифические растворимые TCR; ингибиторы контрольных точек и терапевтические вакцины.В этом обзоре мы уделяем особое внимание ингибиторам контрольных точек и терапевтическим вакцинам, поскольку они способны усиливать как Т-, так и В-клеточный иммунитет. Однако изучаются и другие стратегии, такие как снижение секреции HBsAg из инфицированных гепатоцитов путем блокирования транскрипции мРНК с использованием малых интерферирующих РНК (миРНК), которые подавляют экспрессию специфических вирусных транскриптов (9, 10).
Экспериментальные данные на мышиной модели вируса хронического лимфоцитарного хориоменингита (LCMV) показали, что ингибиторы контрольных точек и терапевтические вакцины могут в некоторой степени повышать противовирусный иммунитет (11, 12).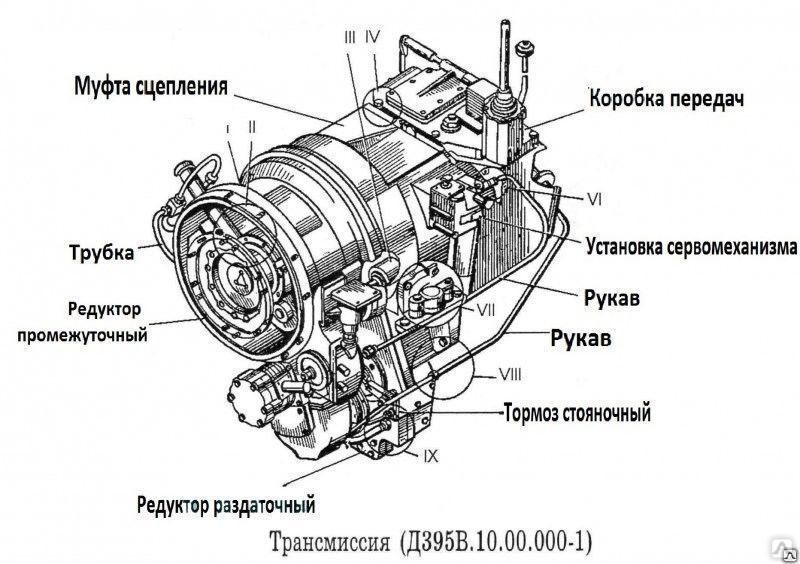 Будут ли подобные подходы достаточными для достижения функционального излечения хронической инфекции ВГВ, еще неизвестно. В ближайшие годы эти стратегии будут оценены для определения их безопасности, эффективности и оптимальной дозировки. В этом контексте выявление пациентов, у которых иммунная система устойчива к этим методам лечения, будет иметь важное значение. Улучшение понимания иммунологических механизмов, связанных с контролем репликации ВГВ, будет способствовать разработке и мониторингу этих вмешательств.
Будут ли подобные подходы достаточными для достижения функционального излечения хронической инфекции ВГВ, еще неизвестно. В ближайшие годы эти стратегии будут оценены для определения их безопасности, эффективности и оптимальной дозировки. В этом контексте выявление пациентов, у которых иммунная система устойчива к этим методам лечения, будет иметь важное значение. Улучшение понимания иммунологических механизмов, связанных с контролем репликации ВГВ, будет способствовать разработке и мониторингу этих вмешательств.
Здесь мы обрисовываем наши текущие представления о контроле ВГВ, который можно наблюдать у людей после острой или хронической разрешающейся инфекции с особым фокусом на Т-клетках. Кроме того, мы предоставляем обзор механизмов и характеристик HBV-специфического истощения Т-клеток и изучаем степень восстановления Т-клеток, которую можно наблюдать при использовании современных методов лечения. Эти параграфы послужат основой для обсуждения обоснования модуляции иммунных контрольных точек и терапевтических вакцин для лечения хронической инфекции ВГВ.
Защитный иммунитет после острой или хронической разрешающейся инфекции ВГВ
Инфекция ВГВ проходит самостоятельно у более чем 95% инфицированных взрослых. Только у небольшой группы пациентов заболевание прогрессирует до хронической стадии, и это чаще происходит у пациентов с ослабленным иммунитетом (13). Однако большинство хронических пациентов с ВГВ инфицируются в раннем возрасте, будучи новорожденными или детьми. Факторы, определяющие исход инфекции, остаются в значительной степени неясными, но некоторые человеческие лейкоцитарные антигены (HLA), такие как HLA-DPA1 и DPA2, связаны с повышенным риском хронической инфекции HBV (14–16).
Имеются убедительные доказательства того, что HBV-специфические Т-клетки необходимы для разрешения вируса. Это подтверждается исследованиями на шимпанзе, в которых истощение CD4 или CD8 Т-клеток приводило к неспособности контролировать острую инфекцию HBV (17, 18). Кроме того, острая разрешающаяся инфекция HBV характеризуется сильными, высокофункциональными Т-клетками, направленными против всех вирусных белков. Разрешение вируса становится очевидным уже во время инкубационной фазы, поскольку уровни ДНК ВГВ начинают снижаться еще до появления симптомов и повреждения печени (19–21).Клинически вирусная резолюция определяется как сероконверсия HBs и неопределяемая ДНК HBV в сыворотке, что обычно происходит в течение первых 24 недель после инфицирования. После сероконверсии HBs частота HBV-специфических Т-клеток снижается и продолжает снижаться, по крайней мере, в течение 40 недель после появления симптомов (22). Остаточный ответ Т-клеток памяти будет сохраняться в течение десятилетий и обеспечивать эффективное сдерживание репликации HBV, в то время как вирусный геном сохраняется в виде кзкДНК внутри гепатоцитов. Точные механизмы Т-клеток, управляющих репликацией HBV, плохо определены, но считается, что они в основном используют нецитопатические эффекторные функции (рис. 1) (23, 24).
Разрешение вируса становится очевидным уже во время инкубационной фазы, поскольку уровни ДНК ВГВ начинают снижаться еще до появления симптомов и повреждения печени (19–21).Клинически вирусная резолюция определяется как сероконверсия HBs и неопределяемая ДНК HBV в сыворотке, что обычно происходит в течение первых 24 недель после инфицирования. После сероконверсии HBs частота HBV-специфических Т-клеток снижается и продолжает снижаться, по крайней мере, в течение 40 недель после появления симптомов (22). Остаточный ответ Т-клеток памяти будет сохраняться в течение десятилетий и обеспечивать эффективное сдерживание репликации HBV, в то время как вирусный геном сохраняется в виде кзкДНК внутри гепатоцитов. Точные механизмы Т-клеток, управляющих репликацией HBV, плохо определены, но считается, что они в основном используют нецитопатические эффекторные функции (рис. 1) (23, 24).
Мы и другие недавно наблюдали различные функции Т-клеток в зависимости от целевого эпитопа HBV (22, 25, 26). Например, при ранней острой инфекции мы наблюдали, что HLA * A2:01 core 18 -специфические Т-клетки характеризовались более высокой экспрессией молекул, таких как гранзим B и перфорин, и демонстрировали более сильный цитокиновый ответ (IFN-γ ) после пептидной стимуляции по сравнению с Т-клетками, специфичными к полимеразе 455 , у одного и того же человека (22). Эти результаты сопровождались отчетливым фенотипом Т-клеток ex vivo .Core 18 -специфические Т-клетки демонстрировали более сильную экспрессию маркеров активации Т-клеток (CD38 и PD-1), имели повышенные уровни фактора транскрипции T-box T-bet по сравнению с полимеразой 455 -специфические Т-клетки ( 27–29). Большинство HBV-специфических Т-клеток были классифицированы как эффекторные клетки памяти, но Т-клетки, специфичные к полимеразе 455 , имели более высокие частоты эффекторных Т-клеток памяти, реэкспрессирующих CD45RA (TEMRA). Эти данные предполагают четкую регуляцию и вклад эпитоп-специфических Т-клеток в контроль вирусов.
Например, при ранней острой инфекции мы наблюдали, что HLA * A2:01 core 18 -специфические Т-клетки характеризовались более высокой экспрессией молекул, таких как гранзим B и перфорин, и демонстрировали более сильный цитокиновый ответ (IFN-γ ) после пептидной стимуляции по сравнению с Т-клетками, специфичными к полимеразе 455 , у одного и того же человека (22). Эти результаты сопровождались отчетливым фенотипом Т-клеток ex vivo .Core 18 -специфические Т-клетки демонстрировали более сильную экспрессию маркеров активации Т-клеток (CD38 и PD-1), имели повышенные уровни фактора транскрипции T-box T-bet по сравнению с полимеразой 455 -специфические Т-клетки ( 27–29). Большинство HBV-специфических Т-клеток были классифицированы как эффекторные клетки памяти, но Т-клетки, специфичные к полимеразе 455 , имели более высокие частоты эффекторных Т-клеток памяти, реэкспрессирующих CD45RA (TEMRA). Эти данные предполагают четкую регуляцию и вклад эпитоп-специфических Т-клеток в контроль вирусов.
Большинство наших представлений о контроле над ВГВ определяется при остром разрешении инфекции у взрослых. Как эти результаты применимы к хроническим пациентам, у которых отсутствует HBsAg, еще предстоит определить. Этих субъектов трудно изучать, поскольку оценки скорости клиренса HBsAg для терапии NA составляют около двух процентов, при этом нет различий между HBeAg-положительными и отрицательными пациентами [рассмотрено в (30)]. По-прежнему необходимы дополнительные исследования, чтобы определить, различаются ли показатели клиренса HBsAg среди разных популяций пациентов и генотипов HBV (31).Недавно сообщалось о защитном эффекте ядерных и полимеразо-специфических Т-клеток против печеночных обострений у пациентов, прекращающих терапию (32). Это может означать, что эти особенности являются привлекательной мишенью для иммунотерапии, в частности потому, что эти особенности часто обнаруживаются при хронической инфекции (22, 25, 33).
Истощение Т-клеток во время хронической инфекции ВГВ
При хронической инфекции HBV-специфические Т-клетки постепенно становятся дисфункциональными и теряют способность к пролиферации, выработке цитокинов и проявлению цитотоксичности по отношению к инфицированным клеткам. Это явление, также известное как истощение Т-клеток, было впервые описано у мышей, хронически инфицированных LCMV (34, 35). Истощение Т-клеток характеризуется устойчивой гиперэкспрессией множества ингибирующих молекул. В конечном итоге сильно истощенные Т-клетки теряются в результате гибели клеток. У пациентов с хронической инфекцией ВГВ проявляются многие признаки истощения Т-клеток. Действительно, частота HBV-специфических Т-клеток снижена, особенно у пациентов с высокой вирусной нагрузкой (36). Остаточный Т-клеточный ответ направлен против ограниченного числа эпитопов, в основном расположенных в сердцевине и полимеразных белках, с небольшим количеством ответов, направленных против оболочечных и Х-белков (25, 33, 37, 38).
Это явление, также известное как истощение Т-клеток, было впервые описано у мышей, хронически инфицированных LCMV (34, 35). Истощение Т-клеток характеризуется устойчивой гиперэкспрессией множества ингибирующих молекул. В конечном итоге сильно истощенные Т-клетки теряются в результате гибели клеток. У пациентов с хронической инфекцией ВГВ проявляются многие признаки истощения Т-клеток. Действительно, частота HBV-специфических Т-клеток снижена, особенно у пациентов с высокой вирусной нагрузкой (36). Остаточный Т-клеточный ответ направлен против ограниченного числа эпитопов, в основном расположенных в сердцевине и полимеразных белках, с небольшим количеством ответов, направленных против оболочечных и Х-белков (25, 33, 37, 38).
Сохранившиеся HBV-специфические Т-клетки избирательно сверхэкспрессируют несколько ингибирующих молекул, из них лучше всего охарактеризован PD-1 (29, 38, 39). Другие ингибирующие рецепторы, такие как LAG-3, TIM-3 и CTLA-4, изучены не так широко. Некоторые из этих маркеров трудно изучать, поскольку они часто незначительно экспрессируются на ВГВ-специфических CD8 Т-клетках в периферической крови (40), но их легче обнаружить на Т-клетках в печени (41). Внутрипеченочные вирус-специфические Т-клетки часто демонстрируют более глубокий фенотип истощения, что отражается в отсутствии маркера памяти CD127 и более сильной совместной экспрессии ингибиторных рецепторов, таких как PD-1 и TIM-3 (36, 39, 41, 42). ).Истощенный фенотип HBV-специфических Т-клеток в равной степени сопровождается функциональными дефектами со сниженной цитотоксической, пролиферативной и митохондриальной функциями (36, 38, 43–46). Интересно, что было обнаружено, что функция истощенных HBV-специфических CD8 T-клеток может быть частично восстановлена путем коррекции митохондриальной дисфункции с помощью митохондриально-направленных антиоксидантов (43).
Внутрипеченочные вирус-специфические Т-клетки часто демонстрируют более глубокий фенотип истощения, что отражается в отсутствии маркера памяти CD127 и более сильной совместной экспрессии ингибиторных рецепторов, таких как PD-1 и TIM-3 (36, 39, 41, 42). ).Истощенный фенотип HBV-специфических Т-клеток в равной степени сопровождается функциональными дефектами со сниженной цитотоксической, пролиферативной и митохондриальной функциями (36, 38, 43–46). Интересно, что было обнаружено, что функция истощенных HBV-специфических CD8 T-клеток может быть частично восстановлена путем коррекции митохондриальной дисфункции с помощью митохондриально-направленных антиоксидантов (43).
HBV-специфическое истощение Т-клеток в основном поддерживается за счет продолжительного воздействия антигенов HBV. Лиганды PD-1, супрессорные цитокины, такие как IL-10 и TGF-ß (47–51), нарушение функции дендритных клеток (DC), естественных киллеров (NK) и повышенная частота регуляторных Т-клеток и супрессоров миелоидного происхождения клеток (MDSC), предполагается, что все они негативно влияют на HBV-специфический Т-клеточный иммунитет (52–61). Вирус также может избегать иммунного давления с помощью вирусных ускользающих мутантов. HBV имеет относительно низкую частоту мутаций, и, поскольку открытые рамки считывания вирусного генома частично перекрываются, количество жизнеспособных аминокислотных замен ограничено. Тем не менее генетическое разнообразие, соответствующее иммунному давлению, наблюдается во время хронической инфекции: в основном в ядре и белке оболочки, но также в меньшей степени в белке полимеразы (62-64). Таким образом, существует множество механизмов, способствующих дисфункции Т-клеток при хронической инфекции ВГВ.Это указывает на то, что модулирование одного пути может не восстановить противовирусный Т-клеточный иммунитет в достаточной степени для достижения функционального излечения хронической инфекции ВГВ.
Вирус также может избегать иммунного давления с помощью вирусных ускользающих мутантов. HBV имеет относительно низкую частоту мутаций, и, поскольку открытые рамки считывания вирусного генома частично перекрываются, количество жизнеспособных аминокислотных замен ограничено. Тем не менее генетическое разнообразие, соответствующее иммунному давлению, наблюдается во время хронической инфекции: в основном в ядре и белке оболочки, но также в меньшей степени в белке полимеразы (62-64). Таким образом, существует множество механизмов, способствующих дисфункции Т-клеток при хронической инфекции ВГВ.Это указывает на то, что модулирование одного пути может не восстановить противовирусный Т-клеточный иммунитет в достаточной степени для достижения функционального излечения хронической инфекции ВГВ.
Восстановление Т-клеток с текущими схемами лечения
Хроническая инфекция HBV представляет собой крайне гетерогенное заболевание, характеризующееся различными уровнями репликации вируса и поражением печени. Клинически это привело к категоризации пациентов на четыре клинические фазы, основанные на различных уровнях в сыворотке ДНК HBV, HBeAg и аланинаминотрансферазы (АЛТ).Лечение NA обычно назначают только в те фазы, когда уровни АЛТ в сыворотке повышены, что указывает на повреждение печени в результате иммуноопосредованного лизиса гепатоцитов (65). Эти фазы наиболее известны как иммунотолерантный (HBeAg-позитивная инфекция), иммуноактивный (HBeAg-положительный гепатит), неактивный носитель (HBeAg-отрицательная инфекция) и HBeAg-отрицательный гепатит (65). Лечение NA высокоэффективно почти у всех пациентов с хроническим ВГВ, что приводит к неопределяемому уровню ДНК ВГВ в сыворотке крови. Что касается Т-клеток, эффективное лечение NA у HBeAg-позитивных хронических пациентов неоднократно ассоциировалось с частичным и преходящим восстановлением HBV-специфических Т-клеток с повышенной пролиферацией и функцией in vitro (66–68).Восстановление функции Т-клеток наблюдается уже через две недели после начала терапии NA (66, 67), но снижается примерно через шесть месяцев лечения (68).
Клинически это привело к категоризации пациентов на четыре клинические фазы, основанные на различных уровнях в сыворотке ДНК HBV, HBeAg и аланинаминотрансферазы (АЛТ).Лечение NA обычно назначают только в те фазы, когда уровни АЛТ в сыворотке повышены, что указывает на повреждение печени в результате иммуноопосредованного лизиса гепатоцитов (65). Эти фазы наиболее известны как иммунотолерантный (HBeAg-позитивная инфекция), иммуноактивный (HBeAg-положительный гепатит), неактивный носитель (HBeAg-отрицательная инфекция) и HBeAg-отрицательный гепатит (65). Лечение NA высокоэффективно почти у всех пациентов с хроническим ВГВ, что приводит к неопределяемому уровню ДНК ВГВ в сыворотке крови. Что касается Т-клеток, эффективное лечение NA у HBeAg-позитивных хронических пациентов неоднократно ассоциировалось с частичным и преходящим восстановлением HBV-специфических Т-клеток с повышенной пролиферацией и функцией in vitro (66–68).Восстановление функции Т-клеток наблюдается уже через две недели после начала терапии NA (66, 67), но снижается примерно через шесть месяцев лечения (68). Продолжительное лечение АН HBeAg-отрицательных пациентов также приводит к частичному, но более длительному восстановлению Т-клеток (69). Частичное восстановление функции Т-клеток после терапии NA в некоторой степени примечательно, поскольку, хотя ДНК HBV становится неопределяемой, эти агенты обычно не снижают уровень HBsAg в сыворотке (70). Персистенция HBsAg может объяснить, почему эти HBV-специфические Т-клетки остаются менее функциональными по сравнению с пациентами, у которых HBsAg исчезает после острой или хронической инфекции (69, 71, 72).Это говорит о том, что только долгосрочное успешное подавление как репликации HBV, так и продукции антигена позволит более глубоко восстановить функцию Т-клеток. С другой стороны, исследования на мышиной модели LCMV и хронической инфекции HCV показывают, что вирусспецифические Т-клетки остаются истощенными даже после полной эрадикации антигена из-за необратимого эпигенетического состояния (73–76). Таким образом, удаление антигена HBV, вероятно, должно сопровождаться дополнительной иммуномодуляцией для достижения функционального излечения.
Продолжительное лечение АН HBeAg-отрицательных пациентов также приводит к частичному, но более длительному восстановлению Т-клеток (69). Частичное восстановление функции Т-клеток после терапии NA в некоторой степени примечательно, поскольку, хотя ДНК HBV становится неопределяемой, эти агенты обычно не снижают уровень HBsAg в сыворотке (70). Персистенция HBsAg может объяснить, почему эти HBV-специфические Т-клетки остаются менее функциональными по сравнению с пациентами, у которых HBsAg исчезает после острой или хронической инфекции (69, 71, 72).Это говорит о том, что только долгосрочное успешное подавление как репликации HBV, так и продукции антигена позволит более глубоко восстановить функцию Т-клеток. С другой стороны, исследования на мышиной модели LCMV и хронической инфекции HCV показывают, что вирусспецифические Т-клетки остаются истощенными даже после полной эрадикации антигена из-за необратимого эпигенетического состояния (73–76). Таким образом, удаление антигена HBV, вероятно, должно сопровождаться дополнительной иммуномодуляцией для достижения функционального излечения.
Блокада иммунных контрольных точек для повышения HBV-специфических Т-клеток
HBV-специфические Т-клетки необходимы для долгосрочного контроля HBV, но становятся функционально дефектными, и их частота значительно снижается при хронической инфекции. Тем не менее, функционально нарушенные Т-клетки сохраняются, что делает их потенциальной мишенью для иммунотерапевтического вмешательства. Один из подходов к усилению HBV-специфических Т-клеток заключается в предотвращении взаимодействия ингибирующих рецепторов на их клеточной поверхности с их лигандами.Исследования на мышах с хроническим LCMV, мышах с HBV и сурках показали, что блокада иммунных контрольных точек может активизировать функцию Т-клеток (11, 77, 78). Аналогичным образом, ранее было описано, что блокирование PD-1 (28, 36, 38, 39, 41), CTLA-4 (43), TIM-3 (40, 42) и 2B4 (44) повышает уровень HBV-специфических Т-клеток. in vitro (рис. 2). Из этих рецепторов PD-1 часто является доминирующим чувствительным рецептором при блокировании in vitro (39). Блокада контрольных точек в основном улучшает пролиферацию Т-клеток и, в меньшей степени, функцию Т-клеток.Не все HBV-специфические Т-клетки одинаково чувствительны к блокаде контрольных точек. Эффекторная память HBV-специфические CD8 T-клетки из периферической крови наиболее чувствительны к блокаде PD-1, аналогично тому, что наблюдается при хроническом гепатите C и ВИЧ-инфекции (39, 79, 80). Внутрипеченочные вирус-специфические Т-клетки часто более истощены, чем их периферические аналоги, и поэтому они выигрывают от блокады дополнительных ингибирующих рецепторов (36, 81). В настоящее время количество клинических испытаний, оценивающих блокаду контрольных точек при хронической инфекции ВГВ, все еще ограничено.Одно из этих исследований было проведено для оценки эффективности клинических испытаний фазы 1/2 для лечения гепатоцеллюлярной карциномы, при этом некоторые пациенты были инфицированы ВГВ, но функция Т-клеток не оценивалась (82). В другом исследовании группа HBeAg-негативных пациентов с хроническим гепатитом В получила однократно низкую дозу ниволумаба для блокирования пути PD-1 (83).
Блокада контрольных точек в основном улучшает пролиферацию Т-клеток и, в меньшей степени, функцию Т-клеток.Не все HBV-специфические Т-клетки одинаково чувствительны к блокаде контрольных точек. Эффекторная память HBV-специфические CD8 T-клетки из периферической крови наиболее чувствительны к блокаде PD-1, аналогично тому, что наблюдается при хроническом гепатите C и ВИЧ-инфекции (39, 79, 80). Внутрипеченочные вирус-специфические Т-клетки часто более истощены, чем их периферические аналоги, и поэтому они выигрывают от блокады дополнительных ингибирующих рецепторов (36, 81). В настоящее время количество клинических испытаний, оценивающих блокаду контрольных точек при хронической инфекции ВГВ, все еще ограничено.Одно из этих исследований было проведено для оценки эффективности клинических испытаний фазы 1/2 для лечения гепатоцеллюлярной карциномы, при этом некоторые пациенты были инфицированы ВГВ, но функция Т-клеток не оценивалась (82). В другом исследовании группа HBeAg-негативных пациентов с хроническим гепатитом В получила однократно низкую дозу ниволумаба для блокирования пути PD-1 (83). В этом исследовании сообщается, что у одного из четырнадцати пациентов достигнуто функциональное излечение, при этом у большинства пациентов наблюдается минимальное снижение уровня HBsAg. Т-клетки, специфичные для сердцевины и оболочки, анализировали с помощью флюоресцентного пятна, но ответы Т-клеток не менялись по частоте с течением времени.В оба исследования были включены пациенты с подавленным вирусом хронического ВГВ, поэтому какого-либо воздействия на ДНК ВГВ обнаружить не удалось. Блокада PD-1 обычно хорошо переносится при низких дозах, но явно потребуются дополнительные исследования дозировок для дальнейшей оценки их эффективности и безопасности, поскольку было проведено лишь несколько небольших исследований. Более высокие дозы или комбинированная терапия могут привести к более выраженному восстановлению Т-клеток, но одновременно повышают риск побочных эффектов, таких как аутоиммунные заболевания и печеночные обострения (84–86).Дальнейшая разработка ингибиторов контрольных точек в качестве стандартного лечения хронической инфекции ВГВ должна четко учитывать их профиль безопасности, поскольку современное лечение АН практически не имеет побочных эффектов и имеет низкую стоимость.
В этом исследовании сообщается, что у одного из четырнадцати пациентов достигнуто функциональное излечение, при этом у большинства пациентов наблюдается минимальное снижение уровня HBsAg. Т-клетки, специфичные для сердцевины и оболочки, анализировали с помощью флюоресцентного пятна, но ответы Т-клеток не менялись по частоте с течением времени.В оба исследования были включены пациенты с подавленным вирусом хронического ВГВ, поэтому какого-либо воздействия на ДНК ВГВ обнаружить не удалось. Блокада PD-1 обычно хорошо переносится при низких дозах, но явно потребуются дополнительные исследования дозировок для дальнейшей оценки их эффективности и безопасности, поскольку было проведено лишь несколько небольших исследований. Более высокие дозы или комбинированная терапия могут привести к более выраженному восстановлению Т-клеток, но одновременно повышают риск побочных эффектов, таких как аутоиммунные заболевания и печеночные обострения (84–86).Дальнейшая разработка ингибиторов контрольных точек в качестве стандартного лечения хронической инфекции ВГВ должна четко учитывать их профиль безопасности, поскольку современное лечение АН практически не имеет побочных эффектов и имеет низкую стоимость.
Рисунок 2 . Иммунотерапевтические варианты восстановления дефектных HBV-специфических Т-клеток. Терапевтические вакцины состоят из антигенов HBV или экспрессируют их. Процессинг этих антигенов профессиональными антигенпрезентирующими клетками (APC) может примировать новые и реактивировать ранее существовавшие HBV-специфические Т-клетки (, левая панель ).Ингибиторы иммунных контрольных точек: моноклональные антитела, которые предотвращают взаимодействие между белком запрограммированной гибели клеток-1 (PD-1) и его лигандом и усиливают функцию HBV-специфических Т-клеток (, правая панель ).
Терапевтические вакцины
В отличие от ингибиторов контрольных точек, которые восстанавливают функцию ранее существовавшего противовирусного иммунитета, терапевтические вакцины предназначены для повышения иммунитета за счет запуска новых противовирусных реакций (рис. 2). Терапевтические вакцины отличаются от профилактических вакцин своим механизмом действия и тем, что их вводят во время инфекции, а не до нее. Терапевтические вакцины основаны на индукции эффективного ответа Т-клеток CD4 и CD8, а не на реакции В-клеток и антител. Более того, антигены вакцины против ВГВ предпочтительно представляются иммунной системе вне печени, что позволяет процессинг профессиональными антигенпрезентирующими клетками, такими как дендритные клетки (87). В целом, на моделях мышей LCMV и HBV имеются существенные данные, подтверждающие использование терапевтической вакцинации для лечения хронических вирусных инфекций (88, 89). К сожалению, многие из этих терапевтических вакцин против ВГВ, полученных на животных моделях, не оценивались на предмет их эффективности у людей, а те, которые обычно проверялись, показали ограниченную эффективность (90–93).Эти наблюдения ясно подчеркивают необходимость оценки эффективности вакцины у пациентов с хронической инфекцией ВГВ. Профилактическая вакцина на основе HBsAg очень эффективна для предотвращения заболевания, главным образом, за счет индукции нейтрализующих антител, в то время как вакцина не индуцирует элиминацию HBsAg у пациентов с хронической инфекцией HBV (94–96).
Терапевтические вакцины основаны на индукции эффективного ответа Т-клеток CD4 и CD8, а не на реакции В-клеток и антител. Более того, антигены вакцины против ВГВ предпочтительно представляются иммунной системе вне печени, что позволяет процессинг профессиональными антигенпрезентирующими клетками, такими как дендритные клетки (87). В целом, на моделях мышей LCMV и HBV имеются существенные данные, подтверждающие использование терапевтической вакцинации для лечения хронических вирусных инфекций (88, 89). К сожалению, многие из этих терапевтических вакцин против ВГВ, полученных на животных моделях, не оценивались на предмет их эффективности у людей, а те, которые обычно проверялись, показали ограниченную эффективность (90–93).Эти наблюдения ясно подчеркивают необходимость оценки эффективности вакцины у пациентов с хронической инфекцией ВГВ. Профилактическая вакцина на основе HBsAg очень эффективна для предотвращения заболевания, главным образом, за счет индукции нейтрализующих антител, в то время как вакцина не индуцирует элиминацию HBsAg у пациентов с хронической инфекцией HBV (94–96). Эти вакцины могли не вызвать функционального излечения, потому что они не были достаточно эффективны, чтобы индуцировать HBV-специфические Т-клетки. Кроме того, ограниченный эффект профилактической вакцины на основе HBsAg при использовании в терапевтических стратегиях можно, по крайней мере частично, объяснить уже высоким уровнем циркулирующего HBsAg у пациентов с хроническим гепатитом В (97).Этому может соответствовать наблюдение, что терапевтическая вакцинация против LCMV более эффективна, когда ее вводят мышам с низкой вирусной антигенной нагрузкой (12). Такие исследования довольно сложно проводить на людях, поскольку современные схемы лечения NA не приводят к значительному снижению уровня HBsAg в сыворотке (70). В более поздних исследованиях оценивались другие и дополнительные антигены ВГВ, такие как сердцевина и белок-полимераза, и оптимизировался способ введения антигена посредством вакцинации рекомбинантным антигеном или ДНК (90–92).На сегодняшний день большинство терапевтических вакцин имели ограниченный успех в клинических испытаниях и индуцировали в лучшем случае лишь частичное восстановление Т-клеток без длительного воздействия на HBsAg и ДНК HBV.
Эти вакцины могли не вызвать функционального излечения, потому что они не были достаточно эффективны, чтобы индуцировать HBV-специфические Т-клетки. Кроме того, ограниченный эффект профилактической вакцины на основе HBsAg при использовании в терапевтических стратегиях можно, по крайней мере частично, объяснить уже высоким уровнем циркулирующего HBsAg у пациентов с хроническим гепатитом В (97).Этому может соответствовать наблюдение, что терапевтическая вакцинация против LCMV более эффективна, когда ее вводят мышам с низкой вирусной антигенной нагрузкой (12). Такие исследования довольно сложно проводить на людях, поскольку современные схемы лечения NA не приводят к значительному снижению уровня HBsAg в сыворотке (70). В более поздних исследованиях оценивались другие и дополнительные антигены ВГВ, такие как сердцевина и белок-полимераза, и оптимизировался способ введения антигена посредством вакцинации рекомбинантным антигеном или ДНК (90–92).На сегодняшний день большинство терапевтических вакцин имели ограниченный успех в клинических испытаниях и индуцировали в лучшем случае лишь частичное восстановление Т-клеток без длительного воздействия на HBsAg и ДНК HBV. Список ранее разработанных и разрабатываемых терапевтических вакцин приведен в другом месте (98–100).
Список ранее разработанных и разрабатываемых терапевтических вакцин приведен в другом месте (98–100).
Ограниченная эффективность современных терапевтических вакцин ставит вопрос о том, не способны ли они омолодить ранее существовавшие HBV-специфические Т-клетки из-за продолжающегося воздействия вирусных антигенов. С другой стороны, антигены вакцины могут не в полной мере соответствовать генотипу ВГВ пациента.Учитывая отсутствие восстановления Т-клеток, кажется, что эти вакцины необходимо вводить в сочетании с другими видами лечения. Для повышения их эффективности вакцинацию в настоящее время комбинируют с блокадой контрольных точек, поскольку эти ингибирующие рецепторы могут ограничивать клональную экспансию Т-клеток. Действительно, положительный эффект блокады PD-1 на терапевтическую вакцинацию наблюдается на модели мышей LCMV и у сурков, инфицированных HBV (101, 102). Кроме того, HBV-специфические Т-клетки, которые были индуцированы дендритными клетками, более чувствительны к блокаде PD-1 по сравнению с теми Т-клетками, которые были примированы гепатоцитами у трансгенных мышей, способных к репликации HBV (103). Однако эти синергетические эффекты не привели к клинической пользе в небольшом пилотном исследовании, в котором ниволумаб и терапевтическая вакцина вводились десяти пациентам с хроническим вирусным гепатитом В с подавленной вирусной нагрузкой (83).
Однако эти синергетические эффекты не привели к клинической пользе в небольшом пилотном исследовании, в котором ниволумаб и терапевтическая вакцина вводились десяти пациентам с хроническим вирусным гепатитом В с подавленной вирусной нагрузкой (83).
В конечном счете, эти вакцины должны в достаточной степени активизировать противовирусный иммунитет, чтобы можно было очистить гепатоциты, инфицированные HBV. Для этого потребуется достаточно широкий репертуар Т-клеток, покрывающий консервативные области вируса, чтобы он мог предотвратить утечку вируса. Одной из трудностей при разработке вакцин на основе эпитопов является ограниченное количество идентифицированных эпитопов HBV класса I и II.Это особенно актуально, поскольку существует четкое глобальное распределение аллелей HLA и генотипов HBV. Тем не менее, большинство эпитопов класса I, доступных для исследований на людях, все еще ограничены HLA-A * 02, и наше понимание генотипической изменчивости HBV-специфических Т-клеточных эпитопов остается ограниченным (104). Включение дегенеративных Т-клеточных эпитопов, т. е. тех, которые могут быть представлены на нескольких аллелях HLA, можно использовать для расширения эффективности вакцины для различных популяций HLA. (105, 106).
Включение дегенеративных Т-клеточных эпитопов, т. е. тех, которые могут быть представлены на нескольких аллелях HLA, можно использовать для расширения эффективности вакцины для различных популяций HLA. (105, 106).
Иммунотерапия при различных фазах хронической инфекции
Текущие руководства рекомендуют лечение NA для хронических пациентов с активным гепатитом и фиброзом от умеренной до тяжелой степени. Однако воспалительные явления и нарушение структуры печени у этих пациентов могут быть менее подходящими для иммунотерапевтического вмешательства, поскольку они могут напрямую препятствовать функции HBV-специфических Т-клеток и доступу к инфицированным гепатоцитам (107, 108). Теоретически иммунотолерантные пациенты могут с большей вероятностью реагировать на иммунотерапию, поскольку у них более сохранная анатомия печени и HBV-специфические Т-клетки (109).В соответствии с этим мнением недавнее исследование показало, что HBV-специфические Т-клетки от 13 иммунотолерантных пациентов имели значительное увеличение продукции IFN-γ в ответ на перекрывающиеся HBV-пептиды после добавления IL-2, в то время как это увеличение не могло наблюдаться у 16 иммуноактивных пациентов. (103). Точно так же судьба истощения Т-клеток может быть более гибкой, если воздействие антигенов ВГВ и других механизмов нарушения иммунитета остается ограниченным. Следует отметить, что лечение иммунотолерантных пациентов все еще остается спорным вопросом, и для дальнейшего обоснования этой гипотезы необходимы более подробные исследования.
(103). Точно так же судьба истощения Т-клеток может быть более гибкой, если воздействие антигенов ВГВ и других механизмов нарушения иммунитета остается ограниченным. Следует отметить, что лечение иммунотолерантных пациентов все еще остается спорным вопросом, и для дальнейшего обоснования этой гипотезы необходимы более подробные исследования.
Будущие перспективы
Имеются обширные данные, указывающие на то, что Т-лимфоциты необходимы для контроля HBV, но эти ответы становятся дефектными у хронических пациентов. Иммунотерапия, направленная на активизацию дисфункциональных Т-клеток, представляет собой логичный подход к функциональному излечению хронической инфекции. Экспериментальные исследования могут предоставить доказательство концепции, но их эффективность не всегда проявляется у хронических пациентов. Во-первых, потому что у хронических пациентов множественные механизмы повреждения Т-клеток действуют в течение десятилетий, и некоторые дефекты Т-клеток могут быть не полностью обратимыми. Недавние усилия начали лучше определять фенотип и функцию HBV-специфических Т-клеток в отношении их эпитопной специфичности. Ингибиторы контрольных точек и терапевтические вакцины до сих пор имели ограниченный успех в небольшом количестве клинических испытаний, при этом в большинстве исследований сообщается лишь о частичном восстановлении Т-клеток. Следует отметить, что оптимальные дозы препаратов и соответствующие сроки их лечения еще предстоит определить. Кроме того, недостаточная эффективность объясняется высоким антигенным бременем, в частности HBsAg, которое не может быть преодолено современными стандартами лечения ВГВ.Для достижения функционального излечения может потребоваться сочетание иммуномодуляции с новыми противовирусными препаратами прямого действия, которые могут ингибировать как репликацию вируса, так и антигенную нагрузку. Ожидается, что благодаря последним методологическим достижениям платформ, таким как многопараметрическая проточная цитометрия и секвенирование РНК HBV-специфических Т-клеток из крови и печени, прогресс в этой области ускорится на беспрецедентном уровне.
Недавние усилия начали лучше определять фенотип и функцию HBV-специфических Т-клеток в отношении их эпитопной специфичности. Ингибиторы контрольных точек и терапевтические вакцины до сих пор имели ограниченный успех в небольшом количестве клинических испытаний, при этом в большинстве исследований сообщается лишь о частичном восстановлении Т-клеток. Следует отметить, что оптимальные дозы препаратов и соответствующие сроки их лечения еще предстоит определить. Кроме того, недостаточная эффективность объясняется высоким антигенным бременем, в частности HBsAg, которое не может быть преодолено современными стандартами лечения ВГВ.Для достижения функционального излечения может потребоваться сочетание иммуномодуляции с новыми противовирусными препаратами прямого действия, которые могут ингибировать как репликацию вируса, так и антигенную нагрузку. Ожидается, что благодаря последним методологическим достижениям платформ, таким как многопараметрическая проточная цитометрия и секвенирование РНК HBV-специфических Т-клеток из крови и печени, прогресс в этой области ускорится на беспрецедентном уровне. Именно с этим возросшим пониманием мы сможем разработать безопасные и эффективные иммунотерапевтические средства против ВГВ.
Именно с этим возросшим пониманием мы сможем разработать безопасные и эффективные иммунотерапевтические средства против ВГВ.
Вклад авторов
RH написал статью. AB написал и отредактировал статью.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Ссылки
3. Yuen M-F, Chen D-S, Dusheiko GM, Janssen HLA, Lau DTY, Locarnini SA, et al. Заражение вирусом гепатита В. Nat Rev Dis Prim .(2018) 4:18035. doi: 10.1038/nrdp.2018.35
Реферат PubMed | Полный текст перекрестной ссылки
7. Kim G-A, Lee HC, Kim M-J, Ha Y, Park EJ, An J и др. Заболеваемость гепатоцеллюлярной карциномой после серологического клиренса HBsAg у пациентов с хроническим гепатитом В: необходимость наблюдения. Дж Гепатол . (2015) 62:1092–9. doi: 10.1016/j.jhep.2014.11.031
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
8. Yuen M-F, Wong DK-H, Fung J, Ip P, But D, Hung I, et al.Сероклиренс HBsAg при хроническом гепатите В у азиатских пациентов: уровень репликации и риск гепатоцеллюлярной карциномы. Гастроэнтерология . (2008) 135:1192–9. doi: 10.1053/j.gastro.2008.07.008
Yuen M-F, Wong DK-H, Fung J, Ip P, But D, Hung I, et al.Сероклиренс HBsAg при хроническом гепатите В у азиатских пациентов: уровень репликации и риск гепатоцеллюлярной карциномы. Гастроэнтерология . (2008) 135:1192–9. doi: 10.1053/j.gastro.2008.07.008
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
9. Yuen M-F, Schiefke I, Yoon J-H, Ahn SH, Heo J, Kim JH, et al. Терапия РНК-интерференцией с помощью ARC-520 приводит к пролонгированному ответу HBsAg у пациентов с хроническим гепатитом В. Гепатология .(2019). doi: 10.1002/hep.31008. [Epub перед печатью].
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
10. Thi EP, Dhillon AP, Ardzinski A, Bidirici-Ertekin L, Cobarrubias KD, Cuconati A, et al. ARB-1740, РНК-интерференционный терапевтический препарат для лечения хронической инфекции гепатита В. ACS Infect Dis . (2019) 5: 725–37. doi: 10.1021/acsinfecdis.8b00191
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
11. Barber DL, Wherry EJ, Masopust D, Zhu B, Allison JP, Sharpe AH, et al.Восстановление функции истощенных CD8 Т-клеток при хронической вирусной инфекции. Природа . (2006) 439: 682–7. doi: 10.1038/nature04444
Barber DL, Wherry EJ, Masopust D, Zhu B, Allison JP, Sharpe AH, et al.Восстановление функции истощенных CD8 Т-клеток при хронической вирусной инфекции. Природа . (2006) 439: 682–7. doi: 10.1038/nature04444
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
12. Wherry EJ, Blattman JN, Ahmed R. Низкий пролиферативный потенциал CD8 T-клеток и высокая вирусная нагрузка ограничивают эффективность терапевтической вакцинации. Дж Вирол . (2005) 79:8960–8. doi: 10.1128/ОВИ.79.14.8960-8968.2005
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
13.Terrault NA, Lok ASF, McMahon BJ, Chang K-M, Hwang JP, Jonas MM, et al. Обновленная информация о профилактике, диагностике и лечении хронического гепатита В: руководство AASLD 2018 по гепатиту В. Гепатология . (2018) 67:1560–99. doi: 10.1002/hep.29800
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
15. О’Брайен Т. Р., Ян Х.И., Грувер С., Дженг В.Дж. Генетические факторы, влияющие на спонтанную элиминацию вируса гепатита С или В, ответ на лечение и прогрессирование заболевания. Гастроэнтерология . (2019) 156:400–17. doi: 10.1053/j.gastro.2018.09.052
Р., Ян Х.И., Грувер С., Дженг В.Дж. Генетические факторы, влияющие на спонтанную элиминацию вируса гепатита С или В, ответ на лечение и прогрессирование заболевания. Гастроэнтерология . (2019) 156:400–17. doi: 10.1053/j.gastro.2018.09.052
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
17. Thimme R, Wieland S, Steiger C, Ghrayeb J, Reimann KA, Purcell RH, et al. CD8(+) Т-клетки опосредуют клиренс вируса и патогенез заболевания во время острой вирусной инфекции гепатита В. Дж Вирол . (2003) 77:68–76. doi: 10.1128/jvi.77.1.68-76.2003
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
18.Asabe S, Wieland SF, Chattopadhyay PK, Roederer M, Engle RE, Purcell RH, et al. Размер вирусного инокулята влияет на исход инфицирования вирусом гепатита В. Дж Вирол . (2009) 83:9652–62. doi: 10.1128/ОВИ.00867-09
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
19. Fisicaro P, Valdatta C, Boni C, Massari M, Mori C, Zerbini A, et al. Ранняя кинетика врожденных и адаптивных иммунных ответов при инфицировании вирусом гепатита В. Гут .(2009) 58:974–82. doi: 10.1136/gut.2008.163600
Fisicaro P, Valdatta C, Boni C, Massari M, Mori C, Zerbini A, et al. Ранняя кинетика врожденных и адаптивных иммунных ответов при инфицировании вирусом гепатита В. Гут .(2009) 58:974–82. doi: 10.1136/gut.2008.163600
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
20. Webster GJ, Reignat S, Maini MK, Whalley SA, Ogg GS, King A, et al. Инкубационный период острого гепатита В у человека: динамика клеточных иммунных механизмов. Гепатология . (2000) 32:1117–24. doi: 10.1053/jhep.2000.19324
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
21. Гвидотти Л.Г., Рочфорд Р., Чанг Дж., Шапиро М., Перселл Р., Чисари Ф.В.Клиренс вируса без разрушения инфицированных клеток при острой HBV-инфекции. Наука . (1999) 284:825–9.
Реферат PubMed | Академия Google
22. Hoogeveen RC, Robidoux MP, Schwarz T, Heydmann L, Cheney JA, Kvistad D, et al. Фенотип и функция HBV-специфических Т-клеток определяются эпитопом-мишенью в дополнение к стадии инфекции. Гут . (2019) 68:893–904. doi: 10.1136/gutjnl-2018-316644
Гут . (2019) 68:893–904. doi: 10.1136/gutjnl-2018-316644
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
23.Гвидотти Л.Г., Исикава Т., Хоббс М.В., Мацке Б., Шрайбер Р., Чисари Ф.В. Внутриклеточная инактивация вируса гепатита В цитотоксическими Т-лимфоцитами. Иммунитет . (1996) 4:25–36.
Реферат PubMed | Академия Google
24. Кафруни М.И., Браун Г.Р., Тиле Д.Л. Вирусно инфицированные гепатоциты устойчивы к перфоринзависимым эффекторным механизмам ЦТЛ. Дж Иммунол . (2001) 167:1566–74. doi: 10.4049/jimmunol.167.3.1566
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
25.Schuch A, Salimi Alizei E, Heim K, Wieland D, Kiraithe MM, Kemming J, et al. Фенотипические и функциональные различия кор-специфичных клеток HBV по сравнению с HBV-полимеразно-специфическими CD8+ T-клетками у хронически инфицированных HBV пациентов с низкой вирусной нагрузкой. Гут . (2019) 68:905–15. doi: 10.1136/gutjnl-2018-316641
doi: 10.1136/gutjnl-2018-316641
Полнотекстовая перекрестная ссылка | Академия Google
26. Cheng Y, Zhu YO, Becht E, Aw P, Chen J, Poidinger M, et al. Многофакторная гетерогенность вирусспецифических Т-клеток и связь с прогрессированием хронического гепатита В человека. Научный Иммунол . (2019) 4: eaau6905. doi: 10.1126/sciimmunol.aau6905
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
27. Беттлер Т., Пантера Э., Бенгш Б., Назарова Н., Спангенберг Х.К., Блюм Х.Э. и соавт. Экспрессия альфа-цепи рецептора интерлейкина-7 (CD127) на вирусспецифических CD8+ Т-клетках идентифицирует функционально и фенотипически определенные Т-клетки памяти во время острой разрешающейся вирусной инфекции гепатита В. Дж Вирол . (2006) 80:3532–40. дои: 10.1128/ОВИ.80.7.3532-3540.2006
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
28. Zhang Z, Jin B, Zhang J-Y, Xu B, Wang H, Shi M, et al. Динамическое снижение экспрессии PD-1 коррелирует с HBV-специфическим развитием CD8 T-клеток памяти у пациентов с острым самоограничивающимся гепатитом B. Дж Гепатол . (2009) 50:1163–73. doi: 10.1016/j.jhep.2009.01.026
Дж Гепатол . (2009) 50:1163–73. doi: 10.1016/j.jhep.2009.01.026
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
29. Kurktschiev PD, Raziorrouh B, Schraut W, Backmund M, Wächtler M, Wendtner C-M, et al.Дисфункциональные CD8+ Т-клетки при гепатитах В и С характеризуются отсутствием антиген-специфической индукции Т-бет. J Exp Med . (2014) 211:2047–59. doi: 10.1084/jem.20131333
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
30. Papatheodoridis G, Vlachogiannakos I, Cholongitas E, Wursthorn K, Thomadakis C, Touloumi G, et al. Прекращение приема пероральных противовирусных препаратов при хроническом гепатите В: систематический обзор. Гепатология . (2016) 63:1481–92. дои: 10.1002/геп.28438
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
31. Лием К.С., Геринг А.Дж., Фельд Дж.Дж., Янссен ХЛА. Проблемы с прекращением долгосрочной терапии аналогами нуклеотидов у пациентов с хроническим гепатитом В Краткое название: конечная терапия хронического гепатита В. Гастроэнтерология . (2020). doi: 10.1053/j.gastro.2019.10.050. [Epubh перед печатью].
Гастроэнтерология . (2020). doi: 10.1053/j.gastro.2019.10.050. [Epubh перед печатью].
Полнотекстовая перекрестная ссылка | Академия Google
32. Ривино Л., Ле Берт Н., Гилл США, Кунасегаран К., Ченг И., Тан Д.З. и соавт.Специфичные для вируса гепатита В Т-клетки связываются с вирусным контролем после прекращения терапии аналогами нуклеоз(т)идов. Дж Клин Инвест . (2018) 128: 668–81. дои: 10.1172/JCI
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
33. Park JJ, Wong DK, Wahed AS, Lee WM, Feld JJ, Terrault N, et al. Специфическая для вируса гепатита В и глобальная дисфункция Т-клеток при хроническом гепатите В. Гастроэнтерология . (2016) 150:684–695.e5. doi: 10.1053/j.gastro.2015.11.050
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
34. Moskophidis D, Lechner F, Pircher H, Zinkernagel RM. Персистенция вируса у остро инфицированных иммунокомпетентных мышей за счет истощения противовирусных цитотоксических эффекторных Т-клеток. Природа . (1993) 362:758–61. дои: 10.1038/362758a0
Природа . (1993) 362:758–61. дои: 10.1038/362758a0
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
35. Zajac AJ, Blattman JN, Murali-Krishna K, Sourdive DJD, Suresh M, Altman JD, et al. Вирусное уклонение от иммунитета из-за персистенции активированных Т-клеток без эффекторной функции. J Exp Med . (1998) 188:2205–13. doi: 10.1084/jem.188.12.2205
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
36. Fisicaro P, Valdatta C, Massari M, Loggi E, Biasini E, Sacchelli L, et al. Противовирусные внутрипеченочные Т-клеточные ответы могут быть восстановлены путем блокирования пути запрограммированной смерти-1 при хроническом гепатите В. Гастроэнтерология . (2010) 138:682–93, 693.e1–4. doi: 10.1053/j.gastro.2009.09.052
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
37.Webster GJM, Reignat S, Brown D, Ogg GS, Jones L, Seneviratne SL, et al. Продольный анализ CD8+ Т-клеток, специфичных к структурным и неструктурным белкам вируса гепатита В, у пациентов с хроническим гепатитом В: значение для иммунотерапии. Дж Вирол . (2004) 78:5707–19. doi: 10.1128/ОВИ.78.11.5707-5719.2004
Дж Вирол . (2004) 78:5707–19. doi: 10.1128/ОВИ.78.11.5707-5719.2004
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
38. Boni C, Fisicaro P, Valdatta C, Amadei B, Di Vincenzo P, Giuberti T, et al. Характеристика специфической дисфункции Т-клеток вируса гепатита В (HBV) при хронической инфекции HBV. Дж Вирол . (2007) 81:4215–25. doi: 10.1128/ОВИ.02844-06
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
39. Bengsch B, Martin B, Thimme R. Восстановление HBV-специфической функции CD8+ T-клеток путем блокады PD-1 у неактивных пациентов-носителей связано с дифференцировкой T-клеток. Дж Гепатол . (2014) 61:1212–9. doi: 10.1016/j.jhep.2014.07.005
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
40. Ву В, Ши Ю, Ли С, Чжан Ю, Лю Ю, Ву Ю, Чен З.Блокада передачи сигналов Tim-3 восстанавливает вирусспецифический CD8 + Т-клеточный ответ у пациентов с хроническим гепатитом В. Eur J Immunol . (2012) 42:1180–91. дои: 10.1002/eji.201141852
Eur J Immunol . (2012) 42:1180–91. дои: 10.1002/eji.201141852
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
41. Zhang Z, Zhang J, Wherry EJ, Jin B, Xu B, Zou Z, et al. Динамическая экспрессия запрограммированной гибели 1 вирусспецифическими CD8 Т-клетками коррелирует с исходом острого гепатита В. Гастроэнтерология . (2008) 134:1938–49.е3. doi: 10.1053/j.gastro.2008.03.037
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
42. Неббиа Г., Пеппа Д., Шурич А., Ханна П., Сингх Х.Д., Ченг И. и др. Активация пути Tim-3/Galectin-9 истощения Т-клеток при хронической инфекции вируса гепатита В. ПЛОС ОДИН . (2012) 7:e47648. doi: 10.1371/journal.pone.0047648
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
43. Шурич А., Ханна П., Лопес А.Р., Хан К.Дж., Пеппа Д., Микко Л. и соавт.Роль коингибирующего рецептора цитотоксического Т-лимфоцитарного антигена-4 на склонных к апоптозу Т-клетках CD8 при персистирующей вирусной инфекции гепатита В. Гепатология . (2011) 53:1494–503. doi: 10.1002/hep.24249
Гепатология . (2011) 53:1494–503. doi: 10.1002/hep.24249
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
44. Raziorrouh B, Schraut W, Gerlach T, Nowack D, Grüner NH, Ulsenheimer A, et al. Иммунорегуляторная роль CD244 при хронической инфекции гепатита В и его ингибирующий потенциал в отношении вирус-специфической функции CD8+ Т-клеток. Гепатология . (2010) 52:1934–47. doi: 10.1002/hep.23936
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
45. Fisicaro P, Barili V, Montanini B, Acerbi G, Ferracin M, Guerrieri F, et al. Воздействие на митохондриальную дисфункцию может восстановить противовирусную активность истощенных HBV-специфических CD8 T-клеток при хроническом гепатите B. Nat Med . (2017) 23:327–36. дои: 10.1038/nm.4275
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
46.Шурич А., Паллетт Л.Дж., Джайбхай Д., Вейнгарден Дж., Отано И., Гилл США и др. Различные метаболические потребности истощенных и функциональных вирус-специфических Т-клеток CD8 у одного и того же хозяина. Представитель ячейки . (2016) 16:1243–52. doi: 10.1016/j.celrep.2016.06.078
Различные метаболические потребности истощенных и функциональных вирус-специфических Т-клеток CD8 у одного и того же хозяина. Представитель ячейки . (2016) 16:1243–52. doi: 10.1016/j.celrep.2016.06.078
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
48. Das A, Hoare M, Davies N, Lopes AR, Dunn C, Kennedy PTF, et al. Функциональный перекос глобальной популяции Т-клеток CD8 при хронической инфекции вируса гепатита В. J Exp Med . (2008) 205:2111–24. doi: 10.1084/jem.20072076
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
49. Брукс Д.Г., Трифило М.Дж., Эдельманн К.Х., Тейтон Л., МакГаверн Д.Б., Oldstone MBA. Интерлейкин-10 определяет вирусный клиренс или персистенцию in vivo . Nat Med . (2006) 12:1301–9. doi: 10.1038/nm1492
Полнотекстовая перекрестная ссылка | Академия Google
50. Peppa D, Micco L, Javaid A, Kennedy PTF, Schurich A, Dunn C, et al.Блокада иммуносупрессивных цитокинов восстанавливает противовирусную функцию NK-клеток при хронической инфекции, вызванной вирусом гепатита В. ПЛОС Патог . (2010) 6:e1001227. doi: 10.1371/journal.ppat.1001227
ПЛОС Патог . (2010) 6:e1001227. doi: 10.1371/journal.ppat.1001227
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
51. Рико М.А., Кирога Х.А., Субира Д., Кастаньон С., Эстебан Дж.М., Пардо М. и соавт. Пролиферация Т-клеток, специфичных для вируса гепатита В, и секреция цитокинов у пациентов с хроническим гепатитом В, положительными на антитела к е, получавших рибавирин и интерферон-альфа. Гепатология . (2001) 33: 295–300. doi: 10.1053/jhep.2001.21147
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
52. Stoop JN, van der Molen RG, Baan CC, van der Laan LJW, Kuipers EJ, Kusters JG, et al. Регуляторные Т-клетки способствуют нарушению иммунного ответа у пациентов с хронической инфекцией, вызванной вирусом гепатита В. Гепатология . (2005) 41:771–8. doi: 10.1002/hep.20649
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
53.Сюй Д., Фу Дж., Джин Л. , Чжан Х., Чжоу С., Цзоу З. и др. Циркулирующие и резидентные CD4+CD25+ регуляторные Т-клетки активно влияют на противовирусный иммунный ответ и прогрессирование заболевания у пациентов с гепатитом В. J Immunol . (2006) 177:739–47. doi: 10.4049/jиммунол.177.1.739
, Чжан Х., Чжоу С., Цзоу З. и др. Циркулирующие и резидентные CD4+CD25+ регуляторные Т-клетки активно влияют на противовирусный иммунный ответ и прогрессирование заболевания у пациентов с гепатитом В. J Immunol . (2006) 177:739–47. doi: 10.4049/jиммунол.177.1.739
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
54. Franzese O, Kennedy PTF, Gehring AJ, Gotto J, Williams R, Maini MK, et al. Модуляция CD8+-T-клеточного ответа регуляторными CD4+ CD25+ Т-клетками у пациентов с вирусной инфекцией гепатита В. Дж Вирол . (2005) 79:3322–8. doi: 10.1128/ОВИ.79.6.3322-3328.2005
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
55. Stoop JN, van der Molen RG, Kuipers EJ, Kusters JG, Janssen HLA. Ингибирование репликации вируса уменьшает регуляторные Т-клетки и усиливает противовирусный иммунный ответ при хроническом гепатите В. Вирусология . (2007) 361:141–8. doi: 10.1016/j.virol.2006.11.018
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
56. Ян Г., Лю А., Се Ц., Го Т.Б., Ван Б., Чжоу Б. и др. Ассоциация регуляторных Т-клеток CD4+CD25+Foxp3+ с хронической активностью и клиренсом вируса у пациентов с гепатитом В. Int Immunol . (2007) 19:133–40. doi: 10.1093/intimm/dxl130
Ян Г., Лю А., Се Ц., Го Т.Б., Ван Б., Чжоу Б. и др. Ассоциация регуляторных Т-клеток CD4+CD25+Foxp3+ с хронической активностью и клиренсом вируса у пациентов с гепатитом В. Int Immunol . (2007) 19:133–40. doi: 10.1093/intimm/dxl130
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
57. Peng G, Li S, Wu W, Sun Z, Chen Y, Chen Z. Циркулирующие CD4 + CD25 + регуляторные Т-клетки коррелируют с хроническим гепатитом В. Иммунология .(2008) 123:57–65. doi: 10.1111/j.1365-2567.2007.02691.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
58. Stoop JN, Claassen MAA, Woltman AM, Binda RS, Kuipers EJ, Janssen HLA, et al. Внутрипеченочные регуляторные Т-клетки фенотипически отличаются от своих периферических аналогов у пациентов с хроническим гепатитом В. Клин Иммунол . (2008) 129:419–27. doi: 10.1016/j.clim.2008.07.029
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
59. Манигольд Т., Раканелли В. Регуляция Т-клеток регуляторными Т-клетками CD4 во время вирусных инфекций гепатита В и С: факты и противоречия. Ланцет Infect Dis . (2007) 7:804–13. дои: 10.1016/S1473-3099(07)70289-X
Манигольд Т., Раканелли В. Регуляция Т-клеток регуляторными Т-клетками CD4 во время вирусных инфекций гепатита В и С: факты и противоречия. Ланцет Infect Dis . (2007) 7:804–13. дои: 10.1016/S1473-3099(07)70289-X
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
61. Pallett LJ, Gill US, Quaglia A, Sinclair LV, Jover-Cobos M, Schurich A, et al. Метаболическая регуляция иммунопатологии гепатита В клетками-супрессорами миелоидного происхождения. Nat Med .(2015) 21: 591–600. дои: 10.1038/nm.3856
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
62. Kefalakes H, Budeus B, Walker A, Jochum C, Hilgard G, Heinold A, et al. Адаптация корового белка вируса гепатита В к давлению отбора CD8(+) Т-клеток. Гепатология . (2015) 62:47–56. doi: 10.1002/hep.27771
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
63. Desmond CP, Gaudieri S, James IR, Pfafferott K, Chopra A, Lau GK, et al. Вирусная адаптация к иммунным ответам хозяина происходит при хронической инфекции вируса гепатита В (HBV), и адаптация является наибольшей при HBV-е антиген-негативном заболевании. Дж Вирол . (2012) 86:1181–92. doi: 10.1128/ОВИ.05308-11
Вирусная адаптация к иммунным ответам хозяина происходит при хронической инфекции вируса гепатита В (HBV), и адаптация является наибольшей при HBV-е антиген-негативном заболевании. Дж Вирол . (2012) 86:1181–92. doi: 10.1128/ОВИ.05308-11
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
64. Ламли С.Ф., Макнотон А.Л., Кленерман П., Литго К.А., Мэтьюз П.С. Адаптация вируса гепатита В к ответу CD8+ Т-клеток: последствия для хозяина и патогена. Фронт Иммунол .(2018) 9:1561. doi: 10.3389/fimmu.2018.01561
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
65. Lampertico P, Agarwal K, Berg T, Buti M, Janssen HLA, Papatheodoridis G, et al. Руководство по клинической практике EASL 2017 по ведению инфекции, вызванной вирусом гепатита В. Дж Гепатол . (2017) 67:370–98. doi: 10.1016/j.jhep.2017.03.021
Полнотекстовая перекрестная ссылка | Академия Google
66. Boni C, Bertoletti A, Penna A, Cavalli A, Pilli M, Urbani S, et al. Лечение ламивудином может восстановить реактивность Т-клеток при хроническом гепатите В. J Clin Invest . (1998) 102:968–75. дои: 10.1172/JCI3731
Лечение ламивудином может восстановить реактивность Т-клеток при хроническом гепатите В. J Clin Invest . (1998) 102:968–75. дои: 10.1172/JCI3731
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
67. Boni C, Penna A, Ogg GS, Bertoletti A, Pilli M, Cavallo C, et al. Лечение ламивудином может преодолеть гипореактивность цитотоксических Т-клеток при хроническом гепатите В: новые перспективы иммунотерапии. Гепатология . (2001) 33:963–71. doi: 10.1053/jhep.2001.23045
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
68. Boni C, Penna A, Bertoletti A, Lamonaca V, Rapti I, Missale G, et al. Временное восстановление противовирусных Т-клеточных ответов, вызванных терапией ламивудином, при хроническом гепатите В. J Гепатол . (2003) 39: 595–605. doi: 10.1016/s0168-8278(03)00292-7
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
69. Boni C, Laccabue D, Lampertico P, Giuberti T, Viganò M, Schivazappa S, et al. Восстановление функции HBV-специфических Т-клеток после длительной эффективной терапии аналогами нуклеоз(т)идов. Гастроэнтерология . (2012) 143:963–73.e9. doi: 10.1053/j.gastro.2012.07.014
Восстановление функции HBV-специфических Т-клеток после длительной эффективной терапии аналогами нуклеоз(т)идов. Гастроэнтерология . (2012) 143:963–73.e9. doi: 10.1053/j.gastro.2012.07.014
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
70. Wursthorn K, Jung M, Riva A, Goodman ZD, Lopez P, Bao W, et al. Кинетика снижения поверхностного антигена гепатита В в течение 3 лет лечения телбивудином у пациентов с положительным е-антигеном гепатита В. Гепатология .(2010) 52:1611–20. doi: 10.1002/hep.23905
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
71. Рехерманн Б., Лау Д., Хуфнагл Дж. Х., Чисари Ф. В. Реактивность цитотоксических Т-лимфоцитов после разрешения хронической вирусной инфекции гепатита В. Дж Клин Инвест . (1996) 97:1655–65. дои: 10.1172/JCI118592
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
72. де Ниет А., Стельма Ф., Янсен Л. , Синниге М.Дж., Реммерсвааль Э.Б.М., Таккенберг Р.Б. и соавт.Восстановление функции Т-клеток у больных хроническим гепатитом В на фоне комбинированной терапии на основе интерферона. Дж Гепатол . (2016) 64: 539–46. doi: 10.1016/j.jhep.2015.10.013
, Синниге М.Дж., Реммерсвааль Э.Б.М., Таккенберг Р.Б. и соавт.Восстановление функции Т-клеток у больных хроническим гепатитом В на фоне комбинированной терапии на основе интерферона. Дж Гепатол . (2016) 64: 539–46. doi: 10.1016/j.jhep.2015.10.013
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
73. Utzschneider DT, Legat A, Fuertes Marraco SA, Carrié L, Luescher I, Speiser DE, et al. Т-клетки сохраняют истощенный фенотип после изъятия антигена и реэкспансии популяции. Нат Иммунол . (2013) 14:603–10.doi: 10.1038/ni.2606
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
74. Wherry EJ, Barber DL, Kaech SM, Blattman JN, Ahmed R. Антиген-независимые CD8 T-клетки памяти не развиваются во время хронической вирусной инфекции. Proc Natl Acad Sci USA . (2004) 101:16004–9. doi: 10.1073/pnas.04071
Полнотекстовая перекрестная ссылка | Академия Google
75. Sen DR, Kaminski J, Barnitz RA, Kurachi M, Gerdemann U, Yates KB, et al. Эпигенетический ландшафт истощения Т-клеток. Наука. (2016) 354:1165–9. doi: 10.1126/science.aae0491
Эпигенетический ландшафт истощения Т-клеток. Наука. (2016) 354:1165–9. doi: 10.1126/science.aae0491
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
76. Паукен К.Е., Саммонс М.А., Одориззи П.М., Манн С., Годек Дж., Хан О. и соавт. Эпигенетическая стабильность истощенных Т-лимфоцитов ограничивает продолжительность реактивации блокадой PD-1. Наука . (2016) 354:1160–5. doi: 10.1126/science.aaf2807
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
77. Zhang E, Zhang X, Liu J, Wang B, Tian Y, Kosinska AD, et al.Экспрессия лигандов PD-1 и их участие в регуляции функций Т-клеток при острой и хронической инфекции вирусом гепатита сурков. ПЛОС ОДИН . (2011) 6:e26196. doi: 10.1371/journal.pone.0026196
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
78. Tzeng H-T, Tsai H-F, Liao H-J, Lin Y-J, Chen L, Chen P-J, et al. Блокирование PD-1 обращает вспять иммунную дисфункцию и персистенцию вируса гепатита В в модели животных мышей. ПЛОС ОДИН . (2012) 7:e39179.doi: 10.1371/journal.pone.0039179
ПЛОС ОДИН . (2012) 7:e39179.doi: 10.1371/journal.pone.0039179
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
79. Bengsch B, Seigel B, Ruhl M, Timm J, Kuntz M, Blum HE, et al. Коэкспрессия PD-1, 2B4, CD160 и KLRG1 на истощенных HCV-специфических CD8+ Т-клетках связана с распознаванием антигена и дифференцировкой Т-клеток. ПЛОС Патог . (2010) 6:e1000947. doi: 10.1371/journal.ppat.1000947
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
80. Соус Д., Алмейда Дж. Р., Ларсен М., Харо Л., Отран Б., Фримен Г. Дж. и др.Экспрессия PD-1 на Т-клетках CD8 человека зависит как от состояния дифференцировки, так и от статуса активации. СПИД . (2007) 21:2005–13. DOI: 10.1097/QAD.0b013e3282eee548
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
81. Fisicaro P, Valdatta C, Massari M, Loggi E, Ravanetti L, Urbani S, et al. Комбинированная блокада запрограммированной смерти-1 и активация CD137 усиливают ответы Т-клеток печени человека против HBV, но не против HCV. Гастроэнтерология .(2012) 143:1576–85.e4. doi: 10.1053/j.gastro.2012.08.041
Гастроэнтерология .(2012) 143:1576–85.e4. doi: 10.1053/j.gastro.2012.08.041
Полнотекстовая перекрестная ссылка | Академия Google
82. Эль-Хуэйри А.Б., Сангро Б., Яу Т., Крочензи Т.С., Кудо М., Хсу С. и соавт. Ниволумаб у пациентов с распространенной гепатоцеллюлярной карциномой. (CheckMate 040): открытое несравнительное исследование фазы 1/2 повышения дозы и расширения доз. Ланцет . (2017) 389: 2492–502. doi: 10.1016/S0140-6736(17)31046-2
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
83.Gane E, Verdon DJ, Brooks AE, Gaggar A, Nguyen AH, Subramanian GM и др. Блокада анти-PD-1 ниволумабом с терапевтической вакцинацией и без нее при хроническом гепатите В с подавленным вирусом: пилотное исследование. Дж Гепатол . (2019) 71:900–7. doi: 10.1016/j.jhep.2019.06.028
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
85. Johnson DB, Balko JM, Compton ML, Chalkias S, Gorham J, Xu Y, et al. Фульминантный миокардит с комбинированной блокадой иммунных контрольных точек. N Английский J Med . (2016) 375:1749–55. дои: 10.1056/NEJMoa1609214
Фульминантный миокардит с комбинированной блокадой иммунных контрольных точек. N Английский J Med . (2016) 375:1749–55. дои: 10.1056/NEJMoa1609214
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
86. Johnson DB, McDonnell WJ, Gonzalez-Ericsson PI, Al-Rohil RN, Mobley BC, Salem J-E, et al. Отчет о случае клональной EBV-подобной активации Т-клеток памяти CD4+ при фатальном энцефалите, индуцированном ингибитором контрольной точки. Nat Med . (2019) 25:1243–50. doi: 10.1038/s41591-019-0523-2
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
87.Боуэн Д.Г., Зен М., Хольц Л., Дэвис Т., МакКоган Г.В., Бертолино П. Место первичной активации Т-клеток является определяющим фактором баланса между внутрипеченочной толерантностью и иммунитетом. Дж Клин Инвест . (2004) 114:701–12. DOI: 10.1172/JCI21593
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
88. Buchmann P, Dembek C, Kuklick L, Jäger C, Tedjokusumo R, von Freyend MJ, et al. Новая терапевтическая вакцина против гепатита В индуцирует клеточный и гуморальный иммунный ответ и нарушает толерантность к вирусу гепатита В.(HBV) трансгенных мышей. Вакцина . (2013) 31:1197–203. doi: 10.1016/j.vaccine.2012.12.074
Новая терапевтическая вакцина против гепатита В индуцирует клеточный и гуморальный иммунный ответ и нарушает толерантность к вирусу гепатита В.(HBV) трансгенных мышей. Вакцина . (2013) 31:1197–203. doi: 10.1016/j.vaccine.2012.12.074
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
89. Martin P, Dubois C, Jacquier E, Dion S, Mancini-Bourgine M, Godon O, et al. TG1050, иммунотерапевтический препарат для лечения хронического гепатита В, индуцирует устойчивые Т-клетки и оказывает противовирусное действие у мышей, устойчивых к ВГВ. Гут . (2015) 64:1961–71. doi: 10.1136/gutjnl-2014-308041
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
90.Зулим Ф., Фурнье С., Хаберсетцер Ф., Спринцль М., Пол С., Коффин С.С. и соавт. Безопасность и иммуногенность терапевтической вакцины TG1050 у пациентов с хроническим гепатитом В: плацебо-контролируемое исследование фазы 1b. Вакцина Hum Immunother . (2019) 16: 388–99. дои: 10.1080/21645515.2019.1651141
дои: 10.1080/21645515.2019.1651141
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
91. Lok AS, Pan CQ, Han S-HB, Trinh HN, Fessel WJ, Rodell T, et al. Рандомизированное исследование фазы II GS-4774 в качестве терапевтической вакцины у пациентов с вирусной супрессией и хроническим гепатитом В. Дж Гепатол . (2016) 65:509–16. doi: 10.1016/j.jhep.2016.05.016
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
92. Boni C, Janssen HLA, Rossi M, Yoon SK, Vecchi A, Barili V, et al. Комбинированная терапия GS-4774 и тенофовиром может улучшить HBV-специфический Т-клеточный ответ у пациентов с хроническим гепатитом. Гастроэнтерология . (2019) 157: 227–41.e7. doi: 10.1053/j.gastro.2019.03.044
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
93.Фонтейн Х., Кахи С., Шазаллон С., Бургин М., Вараут А., Баффет С. и др. Вакцинация против ДНК ВГВ не предотвращает рецидив после прекращения применения аналогов при лечении хронического гепатита В: рандомизированное исследование — ANRS HB02 VAC-ADN. Гут . (2015) 64:139–47. doi: 10.1136/gutjnl-2013-305707
Гут . (2015) 64:139–47. doi: 10.1136/gutjnl-2013-305707
Полнотекстовая перекрестная ссылка | Академия Google
94. Pol S, Nalpas B, Driss F, Michel ML, Tiollais P, Denis J, et al. Эффективность и ограничения специфической иммунотерапии при хроническом гепатите В. Дж Гепатол . (2001) 34:917–21. doi: 10.1016/s0168-8278(01)00028-9
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
95. Vandepapelière P, Lau GKK, Leroux-Roels G, Horsmans Y, Gane E, Tawandee T, et al. Терапевтическая вакцинация пациентов с хроническим гепатитом В с подавлением вируса противовирусной терапией: рандомизированное контролируемое исследование совместного введения вакцины-кандидата HBsAg/AS02 и ламивудина. Вакцина . (2007) 25:8585–97. дои: 10.1016/j.vaccine.2007.09.072
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
96. Ялчин К., Акар М., Дегертекин Х. Специфическая терапия вакциной против гепатита В у неактивных носителей HBsAg: рандомизированное контролируемое исследование. Инфекция . (2003) 31:221–5.
Инфекция . (2003) 31:221–5.
Реферат PubMed | Академия Google
97. Nguyen T, Thompson AJV, Bowden S, Croagh C, Bell S, Desmond PV, et al. Уровни поверхностного антигена гепатита В во время естественного течения хронического гепатита В: взгляд на Азию. Дж Гепатол . (2010) 52:508–13. doi: 10.1016/j.jhep.2010.01.007
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
99. Геринг А.Дж. Новые методы лечения для достижения функционального излечения: обоснование и проблемы новых иммунных методов лечения. Best Pract Res Clin Gastroenterol . (2017) 31:337–45. doi: 10.1016/j.bpg.2017.05.004
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
101. Ha S-J, Mueller SN, Wherry EJ, Barber DL, Aubert RD, Sharpe AH, et al.Усиление терапевтической вакцинации путем блокирования ингибирующих сигналов, опосредованных PD-1, при хронической инфекции. J Exp Med . (2008) 205:543–55. doi: 10.1084/jem.20071949
doi: 10.1084/jem.20071949
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
102. Liu J, Zhang E, Ma Z, Wu W, Kosinska A, Zhang X, et al. Повышение вирусспецифического иммунитета in vivo путем сочетания терапевтической вакцинации и блокады PD-L1 при хронической гепаднавирусной инфекции. ПЛОС Патог . (2014) 10:e1003856.doi: 10.1371/journal.ppat.1003856
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
103. Бенеше А.П., Де Симоне Г., Ди Люсия П., Чиленти Ф., Барбьера Г., Ле Берт Н. и соавт. Динамика и геномный ландшафт CD8+ Т-клеток, подвергающихся печеночному праймированию. Природа . (2019) 574: 200–5. doi: 10.1038/s41586-019-1620-6
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
104. Десмонд С.П., Бартоломеуш А., Гаудьери С., Ревилл П.А., Левин С.Р.Систематический обзор Т-клеточных эпитопов вируса гепатита В: идентификация, генотипическая изменчивость и актуальность для противовирусной терапии. Антивир Тер . (2008) 13:161–75.
Антивир Тер . (2008) 13:161–75.
Реферат PubMed | Академия Google
105. Тимме Р., Чанг К.М., Пембертон Дж., Сетте А., Чисари Ф.В. Дегенеративная иммуногенность HLA-A2-рестриктированного нуклеокапсидного цитотоксического Т-лимфоцитарного эпитопа вируса гепатита В, который также представлен HLA-B51. Дж Вирол . (2001) 75:3984–7. дои: 10.1128/ОВИ.75.8.3984-3987.2001
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
106. Bertoni R, Sidney J, Fowler P, Chesnut RW, Chisari FV, Sette A. Супермотивы, связывающие антиген-связывающие лейкоциты гистосовместимости человека, предсказывают широко перекрестно-реактивные ответы цитотоксических Т-лимфоцитов у пациентов с острым гепатитом. Дж Клин Инвест . (1997) 100:503–13. дои: 10.1172/JCI119559
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
108.Гвидотти Л.Г., Инверсо Д., Сирони Л., Ди Люсия П., Фиораванти Дж., Ганцер Л., Фиокки А. и др. Иммунонадзор за печенью с помощью внутрисосудистых эффекторных CD8+ Т-клеток. Сотовый . (2015) 161:486–500. doi: 10.1016/j.cell.2015.03.005
и др. Иммунонадзор за печенью с помощью внутрисосудистых эффекторных CD8+ Т-клеток. Сотовый . (2015) 161:486–500. doi: 10.1016/j.cell.2015.03.005
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
109. Kennedy PTF, Sandalova E, Jo J, Gill U, Ushiro-Lumb I, Tan AT, et al. Сохраненная функция Т-клеток у детей и молодых людей с иммунотолерантным хроническим гепатитом В. Гастроэнтерология .(2012) 143:637–45. doi: 10.1053/j.gastro.2012.06.009
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Обзор комбинированной стратегии блокады иммунных контрольных точек, фотодинамической терапии и наномедицины против солидных опухолей
https://doi.org/10.1016/j.matdes.2021.109958Get rights and content Подведены итоги блокады контрольных точек (МКБ) в солидной опухоли.Изложены механизмы ИКБ и фотодинамической терапии (ФДТ) против солидных опухолей.
Описаны преимущества и современные применения ФДТ с помощью наночастиц.
Комбинация ICB, PDT и наночастиц является многообещающей стратегией лечения солидных опухолей.
Abstract
За последние десятилетия все большее число новых методов лечения солидных опухолей были одобрены и показали высокую клиническую эффективность, такие как блокада иммунных контрольных точек (ICB), фотодинамическая терапия (PDT) и передовая стратегия наномедицины.Хотя недостаточная способность нацеливания и обширные токсические побочные эффекты ограничивают монотерапию этих методов лечения в клинике, их комбинация может компенсировать дефекты друг друга и дополняюще и синергетически вызывать противоопухолевые эффекты, о чем свидетельствуют доклинические и клинические испытания. Здесь мы обобщаем статус ICB, PDT и нанотехнологий в современной терапии опухолей и фокусируемся на достижениях комбинации трех платформ в доклинических моделях и обсуждаем их будущие направления и клиническое применение.
Ключевые слова
Наночастицы
Наночастицы
Опухоль Микроверея
Иммунотерапия
Иммунотерапия
Комбинированная терапия
Комбинированная терапия
Собеты
ICBСокращения
ICBImmount Checkpoint Blockade
TAAAntigen Antigen
TMEопухоль Microebroment
ROSактивные формы кислорода
ICDиммуногенная гибель клеток
APCантигенпредставляющая клетка
MHCглавный комплекс гистосовместимости
PD-1запрограммированная гибель клеток 1
PD-L1лиганд запрограммированной гибели клеток 1
CTLA-4Ассоциированный белок-4
IDOIndoleamine 2,3-DIOXYGENASE
HPDпроизводная гематопорфирина
HPD HAOP NPH 2 O 2 -o 2 -активируемый и O 2 -Veathing PDT Nanoparticle
PNPполимерный наночастиц
MOFметалл органический каркас
M-MONмагнитный мезо наночастицы пористого органного кремнезема
MDSCсупрессорная клетка миелоидного происхождения
TIM-3Т-клеточный иммуноглобулиновый домен и муциновый домен-3
LAG-3ген 3 активации лимфоцитов
TIGITТ-клеточный иммунорецептор с иммуноглобулином и доменом ITIM
0 ir4 нежелательные явления, связанные с иммунитетом ЦТЛцитотоксические Т-лимфоциты
Рекомендуемые статьиСсылки на статьи (0)
© 2021 The Authors. Опубликовано Elsevier Ltd.
Опубликовано Elsevier Ltd.
Рекомендованные статьи
Ссылки на статьи
Ассоциированные с центросомами регуляторы контрольной точки G2/M как мишени для терапии рака | Молекулярный рак
McCracken M, Olsen M, Chen MS, Jemal A, Thun M, Cokkinides V, Deapen D, Ward E: Заболеваемость раком, смертность и связанные факторы риска среди американцев азиатского происхождения китайского, филиппинского, вьетнамского, корейская и японская национальности. CA Рак J Clin. 2007, 57: 190-205. 10.3322/канжклин.57.4.190
ПабМед Статья Google Scholar
Balducci L, Ershler WB: Рак и старение: взаимосвязь на нескольких уровнях. Нат Рев Рак. 2005, 5: 655-662. 10.1038/нрк1675
КАС пабмед Статья Google Scholar
Шварц Г.К., Шах М.А.: Ориентация на клеточный цикл: новый подход к терапии рака. Дж. Клин Онкол. 2005, 23: 9408-9421. 10.1200/JCO.2005.01.5594
10.1200/JCO.2005.01.5594
КАС пабмед Статья Google Scholar
Besson A, Dowdy SF, Roberts JM: Ингибиторы CDK: регуляторы клеточного цикла и не только. Ячейка Дев. 2008, 14: 159-169. 10.1016/j.devcel.2008.01.013
CAS пабмед Статья Google Scholar
Hengst L, Reed SI: Ингибиторы семейства Cip/Kip. Курр Топ Микробиол Иммунол. 1998, 227: 25-41.
КАС пабмед Google Scholar
Carnero A, Hannon GJ: Семейство ингибиторов CDK INK4. Курр Топ Микробиол Иммунол. 1998, 227: 43-55.
КАС пабмед Google Scholar
Сантамария Д., Ортега С.: Циклины и CDKS в развитии и раке: уроки генетически модифицированных мышей. Фронт биосай. 2006, 11: 1164-1188. 10.2741/1871
КАС пабмед Статья Google Scholar

Sherr CJ, Roberts JM: Ингибиторы CDK: положительные и отрицательные регуляторы прогрессирования G1-фазы. Гены Дев. 1999, 13: 1501-1512. 10.1101/гад.13.12.1501
КАС пабмед Статья Google Scholar
Dash BC, El-Deiry WS: Фосфорилирование p21 в G2/M повышает активность киназы циклин B-Cdc2. Мол Селл Биол. 2005, 25: 3364-3387. 10.1128/MCB.25.8.3364-3387.2005
PubMed Central КАС пабмед Статья Google Scholar
Ронинсон И.Б., Броуде Э.В., Чанг Б.Д.: Если не апоптоз, то что? Индуцированное лечением старение и митотическая катастрофа в опухолевых клетках. Обновление устойчивости к наркотикам. 2001, 4: 303-313. 10.1054/дрруп.2001.0213
КАС пабмед Статья Google Scholar
Исикава К., Исии Х., Сайто Т. Контрольные точки клеточного цикла, зависящие от повреждения ДНК, и стабильность генома. ДНК-клеточная биол. 2006, 25: 406-411. 10.1089/ДНК.2006.25.406
ДНК-клеточная биол. 2006, 25: 406-411. 10.1089/ДНК.2006.25.406
CAS пабмед Статья Google Scholar
Лоффлер Х., Лукас Дж., Бартек Дж., Крамер А.: Структура соответствует функции – центросомы, поддержание генома и реакция на повреждение ДНК. Разрешение ячейки опыта. 2006, 312: 2633-2640. 10.1016/j.yexcr.2006.06.008
PubMed Статья КАС Google Scholar
Смитс В.А., Медема Р.Х. Проверка перехода G(2)/M. Биохим Биофиз Акта. 2001, 1519: 1-12.
КАС пабмед Статья Google Scholar
Takizawa CG, Morgan DO: Контроль митоза путем изменения субклеточного расположения циклин-B1-Cdk1 и Cdc25C. Curr Opin Cell Biol. 2000, 12: 658-665. 10.1016/С0955-0674(00)00149-6
КАС пабмед Статья Google Scholar

Walworth NC: повреждение ДНК: Chk1 и Cdc25 больше, чем кажется на первый взгляд. Curr Opin Genet Dev. 2001, 11: 78-82. 10.1016/С0959-437С(00)00160-С
КАС пабмед Статья Google Scholar
Fletcher L, Cerniglia GJ, Nigg EA, Yend TJ, Muschel RJ: Ингибирование разделения центросом после повреждения ДНК: роль Nek2. Радиационное разрешение 2004, 162: 128-135. 10.1667/RR3211
КАС пабмед Статья Google Scholar
Zhang W, Fletcher L, Muschel RJ: Роль Polo-подобной киназы 1 в ингибировании разделения центросом после воздействия ионизирующего излучения. Дж. Биол. Хим. 2005, 280: 42994-42999. 10.1074/джбк.М505450200
КАС пабмед Статья Google Scholar
Fry AM, Meraldi P, Nigg EA: центросомная функция протеинкиназы Nek2 человека, члена семейства регуляторов клеточного цикла NIMA. Эмбо Дж. 1998, 17: 470-481. 10.1093/emboj/17.2.470
Эмбо Дж. 1998, 17: 470-481. 10.1093/emboj/17.2.470
Центральный пабмед КАС пабмед Статья Google Scholar
Hsu LC, White RL: BRCA1 связан с центросомой во время митоза. Proc Natl Acad Sci USA. 1998, 95: 12983-12988. 10.1073/pnas.95.22.12983
PubMed Central КАС пабмед Статья Google Scholar
Giannakakou P, Sackett DL, Ward Y, Webster KR, Благосклонный MV, Fojo T: р53 связан с клеточными микротрубочками и транспортируется в ядро с помощью динеина. Nat Cell Biol. 2000, 2: 709-717. 10.1038/35036335
КАС пабмед Статья Google Scholar
Takai N, Hamanaka R, Yoshimatsu J, Miyakawa I: Polo-подобные киназы (Plks) и рак. Онкоген. 2005, 24: 287-291. 10.1038/sj.onc.1208272
CAS пабмед Статья Google Scholar

Stewart ZA, Westfall MD, Pietenpol JA: Нарушение регуляции клеточного цикла и противораковая терапия. Trends Pharmacol Sci. 2003, 24: 139-145. 10.1016/S0165-6147(03)00026-9
КАС пабмед Статья Google Scholar
Иванчук С.М., Рутка Ю.Т. Клеточный цикл: ускорители, тормоза и контрольные точки. Нейрохирургия. 2004, 54: 692-699. обсуждение 699–700, 10.1227/01.NEU.0000109534.28063.5D
PubMed Статья Google Scholar
Doxsey S: Переоценка функции центросомы. Nat Rev Mol Cell Biol. 2001, 2: 688-698. 10.1038/35089575
КАС пабмед Статья Google Scholar
Санкаран С., Парвин Д.Д.: Функция центросомы в нормальных и опухолевых клетках. Джей Селл Биохим. 2006, 99: 1240-1250. 10.1002/джкб.21003
КАС пабмед Статья Google Scholar

Hinchcliffe EH, Sluder G: «Для танго нужны двое»: понимание того, как удвоение центросом регулируется на протяжении клеточного цикла.Гены Дев. 2001, 15: 1167-1181. 10.1101/гад.894001
КАС пабмед Статья Google Scholar
Bailly E, Pines J, Hunter T, Bornens M: Цитоплазматическое накопление циклина B1 в клетках человека: ассоциация с устойчивым к детергентам компартментом и с центросомой. Дж. Клеточные науки. 1992, 101 (часть 3): 529–545.
КАС пабмед Google Scholar
Pockwinse SM, Krockmalnic G, Doxsey SJ, Nickerson J, Lian JB, van Wijnen AJ, Stein JL, Stein GS, Penman S: Независимое от клеточного цикла взаимодействие CDC2 с центросомой, которая связана с каркасом промежуточных филаментов ядерного матрикса . Proc Natl Acad Sci USA. 1997, 94: 3022-3027. 10.1073/pnas.94.7.3022
PubMed Central КАС пабмед Статья Google Scholar

Kramer A, Mailand N, Lukas C, Syljuasen RG, Wilkinson CJ, Nigg EA, Bartek J, Lukas J: Chk1, связанный с центросомой, предотвращает преждевременную активацию киназы циклин-B-Cdk1.Nat Cell Biol. 2004, 6: 884-891. 10.1038/ncb1165
PubMed Статья КАС Google Scholar
Lane HA, Nigg EA: Микроинъекция антител выявила важную роль человеческой полоподобной киназы 1 (Plk1) в функциональном созревании митотических центросом. Джей Селл Биол. 1996, 135: 1701-1713. 10.1083/джкб.135.6.1701
КАС пабмед Статья Google Scholar
Berdnik D, Knoblich JA: Drosophila Aurora-A необходим для созревания центросомы и локализации актинзависимого асимметричного белка во время митоза. Карр Биол. 2002, 12: 640-647. 10.1016/С0960-9822(02)00766-2
КАС пабмед Статья Google Scholar
Hames RS, Fry AM: Варианты альтернативного сплайсинга человеческой центросомной киназы Nek2 демонстрируют различные паттерны экспрессии в митозе. Биохим Дж. 2002, 361: 77-85.10.1042/0264-6021:3610077
Биохим Дж. 2002, 361: 77-85.10.1042/0264-6021:3610077
Центральный пабмед КАС пабмед Статья Google Scholar
Blethrow JD, Glavy JS, Morgan DO, Shokat KM: Ковалентный захват киназ-специфических фосфопептидов выявляет субстраты Cdk1-циклина B. Proc Natl Acad Sci USA. 2008, 105: 1442-1447. 10.1073/pnas.0708966105
PubMed Central КАС пабмед Статья Google Scholar
Шмит Т.Л., Ахмад Н.: Регуляция митоза с помощью митотических киназ: новые возможности для лечения рака. Мол Рак Тер. 2007, 6: 1920-1931. 10.1158/1535-7163.МКТ-06-0781
КАС пабмед Статья Google Scholar
Fu J, Bian M, Jiang Q, Zhang C: Роль киназ Aurora в митозе и онкогенезе. Мол Рак Рез. 2007, 5: 1-10. 10.1158/1541-7786.МКР-06-0208
КАС пабмед Статья Google Scholar

Casenghi M, Meraldi P, Weinhart U, Duncan PI, Korner R, Nigg EA: Полоподобная киназа 1 регулирует Nlp, центросомный белок, участвующий в зарождении микротрубочек. Ячейка Дев. 2003, 5: 113-125. 10.1016/С1534-5807(03)00193-С
КАС пабмед Статья Google Scholar
Fortugno P, Wall NR, Giodini A, O’Connor DS, Plescia J, Padgett KM, Tognin S, Marchisio PC, Altieri DC: Survivin существует в иммунохимически различных субклеточных пулах и участвует в функционировании микротрубочек веретена.Дж. Клеточные науки. 2002, 115: 575-585.
КАС пабмед Google Scholar
Shekhar MP, Lyakhovich A, Visscher DW, Heng H, Kondrat N: Сверхэкспрессия Rad6 вызывает многоядерность, амплификацию центросом, аномальный митоз, анеуплоидию и трансформацию. Рак Рез. 2002, 62: 2115-2124.
КАС пабмед Google Scholar

Montagna C, Andrechek ER, Padilla-Nash H, Muller WJ, Ried T: Центросомные аномалии, повторяющиеся делеции хромосомы 4 и геномная амплификация HER2/neu определяют аденокарциному молочной железы мыши, индуцированную мутантным HER2/neu .Онкоген. 2002, 21: 890-898. 10.1038/sj.onc.1205146
CAS пабмед Статья Google Scholar
Saavedra HI, Knauf JA, Shirokawa JM, Wang J, Ouyang B, Elisei R, Stambrook PJ, Fagin JA: Онкоген RAS индуцирует геномную нестабильность в клетках PCCL3 щитовидной железы через путь MAPK. Онкоген. 2000, 19: 3948-3954. 10.1038/sj.onc.1203723
CAS пабмед Статья Google Scholar
Iovino F, Lentini L, Amato A, Di Leonardo A: Острая потеря RB вызывает амплификацию центросом и анеуплоидию в первичных фибробластах мышей. Мол Рак. 2006, 5: 38-10.1186/1476-4598-5-38
PubMed Central пабмед Статья КАС Google Scholar

Hollander MC, Sheikh MS, Bulavin DV, Lundgren K, Augeri-Henmueller L, Shehee R, Molinaro TA, Kim KE, Tolosa E, Ashwell JD: Геномная нестабильность у мышей с дефицитом Gadd45a.Нат Жене. 1999, 23: 176-184. 10.1038/13802
КАС пабмед Статья Google Scholar
Mantel C, Braun SE, Reid S, Henegariu O, Liu L, Hangoc G, Broxmeyer HE: Дефицит p21(cip-1/waf-1) вызывает деформацию ядерной архитектуры, сверхдупликацию центриолей, полиплоидию и расслабление контрольные точки повреждения микротрубочек в гемопоэтических клетках человека. Кровь. 1999, 93: 1390-1398.
КАС пабмед Google Scholar
Гриффин К.С., Симпсон П.Дж., Уилсон К.Р., Такер Дж.: Гены рекомбинации-восстановления млекопитающих XRCC2 и XRCC3 способствуют правильному расхождению хромосом. Nat Cell Biol. 2000, 2: 757-761. 10.1038/35036399
КАС пабмед Статья Google Scholar

Roymans D, Vissenberg K, De Jonghe C, Willems R, Engler G, Kimura N, Grobben B, Claes P, Verbelen JP, Van Broeckhoven C, Slegers H: Идентификация супрессора метастазирования опухоли Nm23-h2 /Nm23-R1 в составе центросомы.Разрешение ячейки опыта. 2001, 262: 145-153. 10.1006/искл.2000.5087
CAS пабмед Статья Google Scholar
Mimori-Kiyosue Y, Shiina N, Tsukita S: Белок аденоматозного полипоза толстой кишки (APC) движется вдоль микротрубочек и концентрируется на их растущих концах в эпителиальных клетках. Джей Селл Биол. 2000, 148: 505-518. 10.1083/jcb.148.3.505
Центр пабмед КАС пабмед Статья Google Scholar
Shinmura K, Bennett RA, Tarapore P, Fukasawa K: Прямые доказательства роли центросомально локализованного p53 в регуляции дупликации центросом. Онкоген. 2007, 26: 2939-2944. 10.1038/sj.onc.1210085
CAS пабмед Статья Google Scholar

D’Assoro AB, Lingle WL, Salisbury JL: Амплификация центросом и развитие рака. Онкоген. 2002, 21: 6146-6153. 10.1038/sj.onc.1205772
PubMed Статья КАС Google Scholar
Kraft C, Herzog F, Gieffers C, Mechtler K, Hagting A, Pines J, Peters JM: Митотическая регуляция комплекса, стимулирующего анафазу человека, путем фосфорилирования. Эмбо Дж. 2003, 22: 6598-6609. 10.1093/emboj/cdg627
Центральный PubMed КАС пабмед Статья Google Scholar
Hagting A, Den Elzen N, Vodermaier HC, Waizenegger IC, Peters JM, Pines J: Протеолиз секурина человека контролируется контрольной точкой веретена и обнаруживается, когда APC/C переключается с активации Cdc20 на Cdh2.Джей Селл Биол. 2002, 157: 1125-1137. 10.1083/jcb.200111001
PubMed Central КАС пабмед Статья Google Scholar

Starita LM, Machida Y, Sankaran S, Elias JE, Griffin K, Schlegel BP, Gygi SP, Parvin JD: BRCA1-зависимое убиквитинирование гамма-тубулина регулирует количество центросом. Мол Селл Биол. 2004, 24: 8457-8466. 10.1128/MCB.24.19.8457-8466.2004
PubMed Central КАС пабмед Статья Google Scholar
Санкаран С., Старита Л.М., Саймонс А.М., Парвин Д.Д.: Идентификация доменов BRCA1, критических для убиквитин-зависимого ингибирования функции центросомы. Рак Рез. 2006, 66: 4100-4107. 10.1158/0008-5472.КАН-05-4430
КАС пабмед Статья Google Scholar
Loffler H, Bochtler T, Fritz B, Tews B, Ho AD, Lukas J, Bartek J, Kramer A: индуцированное повреждением ДНК накопление центросомного Chk1 способствует его функции контрольной точки.Клеточный цикл. 2007, 6: 2541-2548.
ПабМед Статья Google Scholar

Castedo M, Perfettini JL, Roumier T, Yakushijin K, Horne D, Medema R, Kroemer G: Киназа контрольной точки клеточного цикла Chk2 является негативным регулятором митотической катастрофы. Онкоген. 2004, 23: 4353-4361. 10.1038/sj.onc.1207573
CAS пабмед Статья Google Scholar
Yang J, Yu Y, Hamrick HE, Duerksen-Hughes PJ: ATM, ATR и DNA-PK: инициаторы клеточных генотоксических стрессовых реакций.Канцерогенез. 2003, 24: 1571-1580. 10.1093/карцин/bgg137
CAS пабмед Статья Google Scholar
Менойо А., Алаззузи Х., Эспин Э., Арменгол М., Ямамото Х., Шварц С.: Соматические мутации в генах ответа на повреждение ДНК ATR и CHK1 при спорадических опухолях желудка с микросателлитной нестабильностью. Рак Рез. 2001, 61: 7727-7730.
КАС пабмед Google Scholar
Kim MA, Kim HJ, Brown AL, Lee MY, Bae YS, Park JI, Kwak JY, Chung JH, Yun J: Идентификация новых субстратов для киназы контрольных точек человека Chk1 и Chk2 посредством полногеномного скрининга с использованием консенсусного мотива фосфорилирования Chk . Эксп Мол Мед. 2007, 39: 205-212.
Эксп Мол Мед. 2007, 39: 205-212.
КАС пабмед Статья Google Scholar
Bourke E, Dodson H, Merdes A, Cuffe L, Zachos G, Walker M, Gillespie D, Morrison CG: повреждение ДНК вызывает Chk1-зависимую амплификацию центросомы.EMBO Rep. 2007, 8: 603-609. 10.1038/sj.embor.7400962
PubMed Central КАС пабмед Статья Google Scholar
Bertoni F, Codegoni AM, Furlan D, Tibiletti MG, Capella C, Broggini M: Мутации сдвига рамки считывания CHK1 при генетически нестабильном колоректальном раке и раке эндометрия. Гены Хромосомы Рак. 1999, 26: 176-180. 10.1002/(SICI)1098-2264(199910)26:2<176::AID-GCC11>3.0.CO;2-3
CAS пабмед Статья Google Scholar
Mueller PR, Leise WF: Измерение активности киназы Wee. Методы Мол Биол. 2005, 296: 299-328.
КАС пабмед Google Scholar

Porter LA, Donoghue DJ: Cyclin B1 и CDK1: ядерная локализация и вышестоящие регуляторы. Прог Клеточный Цикл Рез. 2003, 5: 335-347.
ПабМед Google Scholar
Jackman M, Lindon C, Nigg EA, Pines J: Активный циклин B1-Cdk1 впервые появляется на центросомах в профазе.Nat Cell Biol. 2003, 5: 143-148. 10.1038/нкб918
КАС пабмед Статья Google Scholar
Boutros R, Dozier C, Ducommun B: Когда и где фосфатазы CDC25. Curr Opin Cell Biol. 2006, 18: 185-191. 10.1016/j.ceb.2006.02.003
CAS пабмед Статья Google Scholar
Yuan J, Eckerdt F, Bereiter-Hahn J, Kurunci-Csacsko E, Kaufmann M, Strebhardt K: Совместное фосфорилирование, включая активность полоподобной киназы 1, регулирует субклеточную локализацию циклина B1.Онкоген. 2002, 21: 8282-8292. 10.1038/sj.onc.1206011
CAS пабмед Статья Google Scholar

Hagting A, Jackman M, Simpson K, Pines J: Транслокация циклина B1 в ядро в профазе требует зависимого от фосфорилирования ядерного импортного сигнала. Карр Биол. 1999, 9: 680-689. 10.1016/С0960-9822(99)80308-С
КАС пабмед Статья Google Scholar
Tsvetkov L, Xu X, Li J, Stern DF: Polo-подобная киназа 1 и Chk2 взаимодействуют и совместно локализуются в центросомах и средней части тела. Дж. Биол. Хим. 2003, 278: 8468-8475. 10.1074/джбк.М211202200
КАС пабмед Статья Google Scholar
Wright JA, Keegan KS, Herendeen DR, Bentley NJ, Carr AM, Hoekstra MF, Concannon P: Мутанты протеинкиназы ATR человека повышают чувствительность к УФ и ионизирующему излучению и отменяют контроль контрольных точек клеточного цикла.Proc Natl Acad Sci USA. 1998, 95: 7445-7450. 10.1073/pnas.95.13.7445
PubMed Central КАС пабмед Статья Google Scholar

Pandita TK, Lieberman HB, Lim DS, Dhar S, Zheng W, Taya Y, Kastan MB: Ионизирующее излучение активирует киназу ATM на протяжении клеточного цикла. Онкоген. 2000, 19: 1386-1391. 10.1038/sj.onc.1203444
CAS пабмед Статья Google Scholar
Canman CE, Lim DS, Cimprich KA, Taya Y, Tamai K, Sakaguchi K, Appella E, Kastan MB, Siliciano JD: Активация киназы ATM ионизирующим излучением и фосфорилированием p53. Наука. 1998, 281: 1677-1679. 10.1126/наука.281.5383.1677
CAS пабмед Статья Google Scholar
Banin S, Moyal L, Shieh S, Taya Y, Anderson CW, Chessa L, Smorodinsky NI, Prives C, Reiss Y, Shiloh Y, Ziv Y: усиленное фосфорилирование p53 с помощью ATM в ответ на повреждение ДНК .Наука. 1998, 281: 1674-1677. 10.1126/наука.281.5383.1674
CAS пабмед Статья Google Scholar

Hirao A, Kong YY, Matsuoka S, Wakeham A, Ruland J, Yoshida H, Liu D, Elledge SJ, Mak TW: Индуцированная повреждением ДНК активация p53 с помощью киназы контрольной точки Chk2. Наука. 2000, 287: 1824-1827. 10.1126/наука.287.5459.1824
CAS пабмед Статья Google Scholar
Hermeking H, Lengauer C, Polyak K, He TC, Zhang L, Thiagalingam S, Kinzler KW, Vogelstein B: 14-3-3 sigma представляет собой регулируемый p53 ингибитор прогрессии G2/M. Мол Ячейка. 1997, 1: 3-11. 10.1016/С1097-2765(00)80002-7
КАС пабмед Статья Google Scholar
Dulic V, Stein GH, Far DF, Reed SI: Ядерное накопление p21Cip1 в начале митоза: роль в переходе G2/M-фазы. Мол Селл Биол. 1998, 18: 546-557.
Центральный пабмед КАС пабмед Статья Google Scholar
Harvey SL, Charlet A, Haas W, Gygi SP, Kellogg DR: Cdk1-зависимая регуляция митотического ингибитора Wee1. Клетка. 2005, 122: 407-420. 10.1016/j.cell.2005.05.029
Клетка. 2005, 122: 407-420. 10.1016/j.cell.2005.05.029
CAS пабмед Статья Google Scholar
Nilsson I, Hoffmann I: Регуляция клеточного цикла с помощью семейства фосфатаз Cdc25.Прог Клеточный Цикл Рез. 2000, 4: 107-114.
КАС пабмед Статья Google Scholar
Carvajal RD, Tse A, Schwartz GK: Киназы Aurora: новые мишени для терапии рака. Клин Рак Рез. 2006, 12: 6869-6875. 10.1158/1078-0432.ККР-06-1405
КАС пабмед Статья Google Scholar
Nigg EA: Polo-подобные киназы: позитивные регуляторы клеточного деления от начала до конца.Curr Opin Cell Biol. 1998, 10: 776-783. 10.1016/С0955-0674(98)80121-С
КАС пабмед Статья Google Scholar
Golsteyn RM, Mundt KE, Fry AM, Nigg EA: Регуляция активности клеточного цикла и субклеточная локализация Plk1, протеинкиназы человека, участвующей в функции митотического веретена. Джей Селл Биол. 1995, 129: 1617-1628. 10.1083/джкб.129.6.1617
Джей Селл Биол. 1995, 129: 1617-1628. 10.1083/джкб.129.6.1617
КАС пабмед Статья Google Scholar
Рошак А.К., Каппер Е.А., Имбургия С., Форнвальд Дж., Скотт Г., Маршалл Л.А. Полоподобная киназа человека, PLK, регулирует cdc2/циклин B посредством фосфорилирования и активации фосфатазы cdc25C. Сотовый сигнал. 2000, 12: 405-411. 10.1016/S0898-6568(00)00080-2
КАС пабмед Статья Google Scholar
Смитс В.А., Кломпмакер Р., Арно Л., Рийксен Г., Нигг Э.А., Медема Р.Х.: Полоподобная киназа-1 является мишенью контрольной точки повреждения ДНК.Nat Cell Biol. 2000, 2: 672-676. 10.1038/35023629
КАС пабмед Статья Google Scholar
Kotani S, Tugendreich S, Fujii M, Jorgensen PM, Watanabe N, Hoog C, Hieter P, Todokoro K: PKA и MPF-активируемая полоподобная киназа регулируют активность комплекса, стимулирующего анафазу, и прогрессирование митоза. Мол Ячейка. 1998, 1: 371-380. 10.1016/С1097-2765(00)80037-4
Мол Ячейка. 1998, 1: 371-380. 10.1016/С1097-2765(00)80037-4
КАС пабмед Статья Google Scholar
Голан А., Юдковский Ю., Гершко А.: Активность циклин-убиквитинлигазы циклосомы/АРС совместно активируется протеинкиназами Cdk1-циклин B и Plk. Дж. Биол. Хим. 2002, 277: 15552-15557. 10.1074/джбк.М111476200
КАС пабмед Статья Google Scholar
van Vugt MA, Smits VA, Klompmaker R, Medema RH: Ингибирование Polo-подобной киназы-1 при повреждении ДНК происходит зависимым от ATM или ATR образом. Дж. Биол. Хим. 2001, 276: 41656-41660.10.1074/джбк.М101831200
КАС пабмед Статья Google Scholar
Helps NR, Luo X, Barker HM, Cohen PT: NIMA-родственная киназа 2 (Nek2), протеинкиназа, регулируемая клеточным циклом, локализованная в центросомах, образует комплекс с протеинфосфатазой 1. Biochem J. 2000 , 349: 509-518. 10.1042/0264-6021:34
Biochem J. 2000 , 349: 509-518. 10.1042/0264-6021:34
Центральный пабмед КАС пабмед Статья Google Scholar
Фрай А.М., Майор Т., Меральди П., Штирхоф Ю.Д., Танака К., Нигг Э.А.: C-Nap1, новый центросомный спирально-спиральный белок и кандидат в субстрат протеинкиназы Nek2, регулируемой клеточным циклом. Джей Селл Биол. 1998, 141: 1563-1574. 10.1083/jcb.141.7.1563
PubMed Central КАС пабмед Статья Google Scholar
Mayor T, Hacker U, Stierhof YD, Nigg EA: Механизм, регулирующий диссоциацию центросомного белка C-Nap1 от полюсов митотического веретена.Дж. Клеточные науки. 2002, 115: 3275-3284.
КАС пабмед Google Scholar
Rapley J, Baxter JE, Blot J, Wattam SL, Casenghi M, Meraldi P, Nigg EA, Fry AM: Координация регуляции материнского компонента центриолей nlp с помощью протеинкиназ nek2 и plk1. Мол Селл Биол. 2005, 25: 1309-1324. 10.1128/MCB.25.4.1309-1324.2005
Мол Селл Биол. 2005, 25: 1309-1324. 10.1128/MCB.25.4.1309-1324.2005
PubMed Central КАС пабмед Статья Google Scholar
Zaffaroni N, Pennati M, Daidone MG: Survivin как мишень для новых противоопухолевых вмешательств. J Cell Mol Med. 2005, 9: 360-372. 10.1111/j.1582-4934.2005.tb00361.x
CAS пабмед Статья Google Scholar
Carvalho A, Carmena M, Sambade C, Earnshaw WC, Wheatley SP: Survivin необходим для стабильной активации контрольной точки в обработанных таксолом клетках HeLa. Дж. Клеточные науки. 2003, 116: 2987-2998. 10.1242/jcs.00612
CAS пабмед Статья Google Scholar
Deveraux QL, Reed JC: Белки семейства IAP – супрессоры апоптоза. Гены Дев. 1999, 13: 239-252. 10.1101/гад.13.3.239
КАС пабмед Статья Google Scholar

O’Connor DS, Wall NR, Porter AC, Altieri DC: Контрольная точка выживаемости p34(cdc2) при раке. Раковая клетка. 2002, 2: 43-54. 10.1016/S1535-6108(02)00084-3
PubMed Статья Google Scholar
Hsu LC, Doan TP, White RL: Идентификация гамма-тубулин-связывающего домена в BRCA1. Рак Рез. 2001, 61: 7713-7718.
КАС пабмед Google Scholar
Zheng L, Annab LA, Afshari CA, Lee WH, Boyer TG: BRCA1 опосредует лиганд-независимую репрессию транскрипции рецептора эстрогена. Proc Natl Acad Sci USA. 2001, 98: 9587-9592. 10.1073/pnas.171174298
PubMed Central КАС пабмед Статья Google Scholar
Yarden RI, Pardo-Reoyo S, Sgagias M, Cowan KH, Brody LC: BRCA1 регулирует контрольную точку G2/M, активируя киназу Chk1 при повреждении ДНК. Нат Жене. 2002, 30: 285-289. 10.1038/ng837
PubMed Статья Google Scholar

Ye Q, Hu YF, Zhong H, Nye AC, Belmont AS, Li R: BRCA1-индуцированное крупномасштабное разворачивание хроматина и аллель-специфические эффекты предрасполагающих к раку мутаций. Джей Селл Биол. 2001, 155: 911-921. 10.1083/jcb.200108049
Центр PubMed КАС пабмед Статья Google Scholar
Okada S, Ouchi T: Различия в клеточном цикле фосфорилирования BRCA1, вызванного повреждением ДНК, влияют на его субклеточную локализацию. Дж. Биол. Хим. 2003, 278: 2015-2020. 10.1074/джбк.М208685200
КАС пабмед Статья Google Scholar
Deng CX: BRCA1: контрольная точка клеточного цикла, генетическая нестабильность, реакция на повреждение ДНК и эволюция рака.Нуклеиновые Кислоты Res. 2006, 34: 1416-1426. 10.1093/nar/gkl010
Центр PubMed КАС пабмед Статья Google Scholar

Ha BH, Kim EE: Структуры протеаз для убиквитина и убиквитин-подобных модификаторов. BMB Rep. 2008, 41: 435-443.
КАС пабмед Статья Google Scholar
Wasch R, Engelbert D: Комплексозависимый протеолиз регуляторов клеточного цикла, стимулирующий анафазу, и геномная нестабильность раковых клеток.Онкоген. 2005, 24: 1-10. 10.1038/sj.onc.1208017
PubMed Статья КАС Google Scholar
Reiter R, Gais P, Jutting U, Steuer-Vogt MK, Pickhard A, Bink K, Rauser S, Lassmann S, Hofler H, Werner M, Walch A: Aurora kinase Сверхэкспрессия матричной РНК коррелирует с прогрессирование опухоли и сокращение выживаемости при плоскоклеточном раке головы и шеи. Клин Рак Рез. 2006, 12: 5136-5141. 10.1158/1078-0432.CCR-05-1650
КАС пабмед Статья Google Scholar
Hayward DG, Clarke RB, Faragher AJ, Pillai MR, Hagan IM, Fry AM: Центросомальная киназа Nek2 демонстрирует повышенный уровень экспрессии белка при раке молочной железы человека. Рак Рез. 2004, 64: 7370-7376. 10.1158/0008-5472.КАН-04-0960
Рак Рез. 2004, 64: 7370-7376. 10.1158/0008-5472.КАН-04-0960
КАС пабмед Статья Google Scholar
Altieri DC: Survivin, универсальная модуляция клеточного деления и апоптоза при раке.Онкоген. 2003, 22: 8581-8589. 10.1038/sj.onc.1207113
CAS пабмед Статья Google Scholar
Guan Z, Wang XR, Zhu XF, Huang XF, Xu J, Wang LH, Wan XB, Long ZJ, Liu JN, Feng GK: Aurora-A, отрицательный прогностический маркер, увеличивает миграцию и снижает радиочувствительность в раковых клетках. Рак Рез. 2007, 67: 10436-10444. 10.1158/0008-5472.КАН-07-1379
КАС пабмед Статья Google Scholar
Landen CN, Lin YG, Immaneni A, Deavers MT, Merritt WM, Spannuth WA, Bodurka DC, Gershenson DM, Brinkley WR, Sood AK: Сверхэкспрессия центросомного протеинкиназы Aurora-A связана с плохим прогнозом у пациентов с эпителиальным раком яичников . Клин Рак Рез. 2007, 13: 4098-4104. 10.1158/1078-0432.ККР-07-0431
Клин Рак Рез. 2007, 13: 4098-4104. 10.1158/1078-0432.ККР-07-0431
КАС пабмед Статья Google Scholar
Park HS, Park WS, Bondaruk J, Tanaka N, Katayama H, Lee S, Spiess PE, Steinberg JR, Wang Z, Katz RL: Количественное определение числа копий гена киназы Aurora A в осадках мочи и раке мочевого пузыря обнаружение.J Natl Cancer Inst. 2008, 100: 1401-1411. 10.1093/jnci/djn304
Центральный пабмед КАС пабмед Статья Google Scholar
Сен С., Чжоу Х., Чжан Р.Д., Юн Д.С., Вакар-Лопес Ф., Ито С., Цзян Ф., Джонстон Д., Гроссман Х.Б., Руйфрок А.С.: Амплификация/сверхэкспрессия гена митотической киназы при раке мочевого пузыря человека . J Natl Cancer Inst. 2002, 94: 1320-1329.
КАС пабмед Статья Google Scholar
Weichert W, Ullrich A, Schmidt M, Gekeler V, Noske A, Niesporek S, Buckendahl AC, Dietel M, Denkert C: Модели экспрессии полоподобной киназы 1 при раке желудка человека. Онкологические науки. 2006, 97: 271-276. 10.1111/j.1349-7006.2006.00170.x
Онкологические науки. 2006, 97: 271-276. 10.1111/j.1349-7006.2006.00170.x
CAS пабмед Статья Google Scholar
Weichert W, Kristiansen G, Schmidt M, Gekeler V, Noske A, Niesporek S, Dietel M, Denkert C: Экспрессия полоподобной киназы 1 является прогностическим фактором рака толстой кишки человека.Мир J Гастроэнтерол. 2005, 11: 5644-5650.
Центральный пабмед КАС пабмед Статья Google Scholar
Meraldi P, Nigg EA: Сплоченность центросом регулируется балансом активности киназы и фосфатазы. Дж. Клеточные науки. 2001, 114: 3749-3757.
КАС пабмед Google Scholar
Faragher AJ, Fry AM: киназа Nek2A стимулирует расхождение центросом и необходима для образования биполярных митотических веретен.Мол Биол Селл. 2003, 14: 2876-2889. 10.1091/mbc.E03-02-0108
PubMed Central КАС пабмед Статья Google Scholar

Neckers L: Ингибиторы Hsp90 как новые химиотерапевтические средства против рака. Тренды Мол Мед. 2002, 8: С55-61. 10.1016/С1471-4914(02)02316-С
КАС пабмед Статья Google Scholar
Basto R, Gergely F, Draviam VM, Ohkura H, Liley K, Raff JW: Hsp90 необходим для локализации циклина B и Msps/ch-TOG в митотическом веретене дрозофилы и человека.Дж. Клеточные науки. 2007, 120: 1278-1287. 10.1242/jcs.000604
CAS пабмед Статья Google Scholar
Сенджу М., Суеока Н., Сато А., Иванага К., Сакао Ю., Томимицу С., Томинага М., Ирие К., Хаяши С., Суеока Е. Ингибиторы Hsp90 вызывают остановку G2/M, связанную с уменьшением Cdc25C и Cdc2 в клеточных линиях рака легкого. J Cancer Res Clin Oncol. 2006, 132: 150-158. 10.1007/s00432-005-0047-7
КАС пабмед Статья Google Scholar

Заджак М., Монео М.В., Карнеро А., Бенитес Дж., Мартинес-Дельгадо Б.: Митотическая катастрофическая гибель клеток, вызванная ингибитором белка теплового шока 90, в клеточных линиях рака молочной железы с дефицитом BRCA1. Мол Рак Тер. 2008, 7: 2358-2366. 10.1158/1535-7163.МКТ-08-0327
КАС пабмед Статья Google Scholar
Накаяма К.И., Накаяма К. Убиквитинлигазы: контроль клеточного цикла и рак. Нат Рев Рак. 2006, 6: 369-381. 10.1038/нрк1881
КАС пабмед Статья Google Scholar
Hlubek F, Pfeiffer S, Budcies J, Spaderna S, Jung A, Kirchner T, Brabletz T: Экспрессия секурина (hPTTG1) регулируется бета-катенином/TCF при колоректальной карциноме человека. Бр Дж Рак. 2006, 94: 1672-1677.
Центральный пабмед КАС пабмед Google Scholar
Ogbagabriel S, Fernando M, Waldman FM, Bose S, Heaney AP: Securin сверхэкспрессируется при раке молочной железы. Мод Патол. 2005, 18: 985-990. 10.1038/модпатол.3800382
Мод Патол. 2005, 18: 985-990. 10.1038/модпатол.3800382
CAS пабмед Статья Google Scholar
Холлштейн М., Сидрански Д., Фогельштейн Б., Харрис К.С.: мутации p53 при раке человека. Наука. 1991, 253: 49-53. 10.1126/наука.1
CAS пабмед Статья Google Scholar
Орен М.: Принятие решений по p53: жизнь, смерть и рак. Смерть клеток 2003, 10: 431-442. 10.1038/sj.cdd.4401183
CAS пабмед Статья Google Scholar
Нюберг К.А., Майкельсон Р.Дж., Патнэм К.В., Вейнерт Т.А.: На пути к сохранению генома: контрольные точки повреждения ДНК и репликации. Анну Рев Жене. 2002, 36: 617-656. 10.1146/annurev.genet.36.060402.113540
CAS пабмед Статья Google Scholar
Санкар А., Линдси-Больц Л. А., Унсал-Качмаз К., Линн С.: Молекулярные механизмы репарации ДНК млекопитающих и контрольные точки повреждения ДНК. Анну Рев Биохим. 2004, 73: 39-85. 10.1146/год.биохим.73.011303.073723
А., Унсал-Качмаз К., Линн С.: Молекулярные механизмы репарации ДНК млекопитающих и контрольные точки повреждения ДНК. Анну Рев Биохим. 2004, 73: 39-85. 10.1146/год.биохим.73.011303.073723
CAS пабмед Статья Google Scholar
Crescenzi E, Palumbo G, de Boer J, Brady HJ: Мутированная атаксия телеангиэктазии и p21CIP1 модулируют выживаемость клеток стареющих опухолевых клеток, индуцированных лекарствами: значение для химиотерапии. Клин Рак Рез. 2008, 14: 1877-1887. 10.1158/1078-0432.ККР-07-4298
КАС пабмед Статья Google Scholar
Cortez D: кофеин ингибирует ответы контрольных точек, не ингибируя протеинкиназы с мутацией атаксии-телеангиэктазии (ATM) и ATM- и Rad3-родственные (ATR). Дж. Биол. Хим. 2003, 278: 37139-37145. 10.1074/джбк.М307088200
КАС пабмед Статья Google Scholar

Takeuchi A, Tsuchiya H, Yamamoto N, Hayashi K, Yamauchi K, Kawahara M, Miyamoto K, Tomita K: Химиотерапия с потенцированием кофеином для пациентов с саркомой мягких тканей высокой степени злокачественности: долгосрочный клинический результат.Противораковый Рез. 2007, 27: 3489-3495.
КАС пабмед Google Scholar
Qamar L, Davis R, Anwar A, Behbakht K: Ингибитор протеинкиназы C Go6976 усиливает индуцированное кофеином реверсирование химиорезистентности к цис-диамминдихлорплатине-II (CDDP) в модели рака яичников человека. Гинекол Онкол. 2008, 110: 425-431. 10.1016/j.ygyno.2008.04.039
CAS пабмед Статья Google Scholar
Hickson I, Zhao Y, Richardson CJ, Green SJ, Martin NM, Orr AI, Reaper PM, Jackson SP, Curtin NJ, Smith GC: Идентификация и характеристика нового и специфического ингибитора мутированной киназы атаксии-телеангиэктазии ATM. Рак Рез. 2004, 64: 9152-9159. 10.1158/0008-5472.КАН-04-2727
Рак Рез. 2004, 64: 9152-9159. 10.1158/0008-5472.КАН-04-2727
КАС пабмед Статья Google Scholar
Hashimoto O, Shinkawa M, Torimura T, Nakamura T, Selvendiran K, Sakamoto M, Koga H, Ueno T, Sata M: Регуляция клеточного цикла с помощью ингибитора Wee1 PD0166285, пиридо [2, 3-d] пиимидин в клеточной линии меланомы мышей B16.БМК Рак. 2006, 6: 292-10.1186/1471-2407-6-292
PubMed Central пабмед Статья КАС Google Scholar
Payton M, Chung G, Yakowec P, Wong A, Powers D, Xiong L, Zhang N, Leal J, Bush TL, Santora V: Открытие и оценка двойных ингибиторов CDK1 и CDK2. Рак Рез. 2006, 66: 4299-4308. 10.1158/0008-5472.КАН-05-2507
КАС пабмед Статья Google Scholar
Motwani M, Jung C, Sirotnak FM, She Y, Shah MA, Gonen M, Schwartz GK: усиление апоптоза и регрессии опухоли флавопиридолом в присутствии CPT-11 в монослоях и ксенотрансплантатах рака толстой кишки Hct116. Клин Рак Рез. 2001, 7: 4209-4219.
Клин Рак Рез. 2001, 7: 4209-4219.
КАС пабмед Google Scholar
Wall NR, O’Connor DS, Plescia J, Pommier Y, Altieri DC: Подавление фосфорилирования сурвивина на Thr34 флавопиридолом усиливает апоптоз опухолевых клеток.Рак Рез. 2003, 63: 230-235.
КАС пабмед Google Scholar
Li Y, Tanaka K, Li X, Okada T, Nakamura T, Takasaki M, Yamamoto S, Oda Y, Tsuneyoshi M, Iwamoto Y: Ингибитор циклинзависимой киназы, флавопиридол, индуцирует апоптоз и подавляет рост опухоли при лекарственно-устойчивой остеосаркоме и опухолевых клетках семейства Юинга. Инт Джей Рак. 2007, 121: 1212-1218. 10.1002/ijc.22820
КАС пабмед Статья Google Scholar
Smith ME, Cimica V, Chinni S, Challagulla K, Mani S, Kalpana GV: Рост рабдоидной опухоли подавляется флавопиридолом. Клин Рак Рез. 2008, 14: 523-532. 10.1158/1078-0432.ККР-07-1347
10.1158/1078-0432.ККР-07-1347
КАС пабмед Статья Google Scholar
Jackman KM, Frye CB, Hunger SP: Флавопиридол проявляет доклиническую активность при остром лимфобластном лейкозе. Детский рак крови. 2008, 50: 772-778. 10.1002/pbc.21386
PubMed Статья Google Scholar
Motwani M, Rizzo C, Sirotnak F, She Y, Schwartz GK: Флавопиридол усиливает действие доцетаксела in vitro и in vivo на клетки рака желудка человека. Мол Рак Тер. 2003, 2: 549-555.
КАС пабмед Google Scholar
Библия KC, Kaufmann SH: Цитотоксический синергизм между флавопиридолом (NSC 649890, L86-8275) и различными противоопухолевыми агентами: важность последовательности введения. Рак Рез. 1997, 57: 3375-3380.
КАС пабмед Google Scholar

Motwani M, Delohery TM, Schwartz GK: Последовательное зависимое усиление активации каспаз и апоптоза флавопиридолом на обработанных паклитакселом клетках рака желудка и молочной железы человека. Клин Рак Рез. 1999, 5: 1876-1883.
КАС пабмед Google Scholar
George S, Kasimis BS, Cogswell J, Schwarzenberger P, Shapiro GI, Fidias P, Bukowski RM: Фаза I исследования флавопиридола в комбинации с паклитакселом и карбоплатином у пациентов с немелкоклеточным раком легкого.Клин Рак легких. 2008, 9: 160-165. 10.3816/CLC.2008.n.024
КАС пабмед Статья Google Scholar
Jung CP, Motwani MV, Schwartz GK: Флавопиридол повышает чувствительность к гемцитабину в клеточных линиях рака желудочно-кишечного тракта человека и коррелирует с подавлением субъединицы рибонуклеотидредуктазы M2. Клин Рак Рез. 2001, 7: 2527-2536.
КАС пабмед Google Scholar

Choi EJ, Kim GH: Даидзеин вызывает остановку клеточного цикла на фазах G1 и G2/M в клетках MCF-7 и MDA-MB-453 рака молочной железы человека. Фитомедицина. 2008, 15 (9): 683-90. Epub 2008 9 июня, 10.1016/j.phymed.2008.04.006
CAS пабмед Статья Google Scholar
Lin CC, Lin SY, Chung JG, Lin JP, Chen GW, Kao ST: Понижающая регуляция циклина B1 и повышающая регуляция Wee1 берберином способствует переходу лейкозных клеток в фазу G2/M клеточного цикла.Противораковый Рез. 2006, 26: 1097-1104.
КАС пабмед Google Scholar
Lin JP, Yang JS, Lee JH, Hsieh WT, Chung JG: Берберин вызывает остановку клеточного цикла и апоптоз в клеточной линии карциномы желудка человека SNU-5. Мир J Гастроэнтерол. 2006, 12: 21-28.
Центральный пабмед КАС пабмед Google Scholar
Wang GT, Li G, Mantei RA, Chen Z, Kovar P, Gu W, Xiao Z, Zhang H, Sham HL, Sowin T: 1-(5-хлор-2-алкоксифенил)-3- (5-цианопиразин-2-ил)мочевины [коррекция цианопирази] как мощные и селективные ингибиторы киназы Chk1: синтез, предварительный SAR и биологическая активность. J Med Chem. 2005, 48: 3118-3121. 10.1021/джм048989д
J Med Chem. 2005, 48: 3118-3121. 10.1021/джм048989д
КАС пабмед Статья Google Scholar
Syljuasen RG, Sorensen CS, Hansen LT, Fugger K, Lundin C, Johansson F, Helleday T, Sehested M, Lukas J, Bartek J: ингибирование Chk1 человека вызывает повышенную инициацию репликации ДНК, фосфорилирование ATR мишени и разрыв ДНК. Мол Селл Биол. 2005, 25: 3553-3562. 10.1128/MCB.25.9.3553-3562.2005
PubMed Central КАС пабмед Статья Google Scholar
Tse AN, Carvajal R, Schwartz GK: Нацеливание на киназу контрольной точки 1 в терапии рака. Клин Рак Рез. 2007, 13: 1955-1960. 10.1158/1078-0432.ККР-06-2793
КАС пабмед Статья Google Scholar
Це А.Н., Шейх Т.Н., Алан Х., Чоу Т.С., Шварц Г.К.: Ингибирование белка теплового шока 90 кДа отменяет индуцированную ядом топоизомеразы I контрольную точку G2/M в p53-нулевых опухолевых клетках путем истощения Chk1 и Wee1 . Мол Фармакол.2009, 75: 124-133. 10.1124/моль.108.050807
Мол Фармакол.2009, 75: 124-133. 10.1124/моль.108.050807
PubMed Central КАС пабмед Статья Google Scholar
Mesa RA, Loegering D, Powell HL, Flatten K, Arlander SJ, Dai NT, Heldebrant MP, Vroman BT, Smith BD, Karp JE: ингибирование белка теплового шока 90 повышает чувствительность клеток острого миелогенного лейкоза к цитарабину. Кровь. 2005, 106: 318-327. 10.1182/blood-2004-09-3523
PubMed Central КАС пабмед Статья Google Scholar
Banerji U: Белок теплового шока 90 как мишень для лекарства: некоторые любят погорячее. Клин Рак Рез. 2009, 15: 9-14. 10.1158/1078-0432.ККР-08-0132
КАС пабмед Статья Google Scholar
Matthews DJ, Yakes FM, Chen J, Tadano M, Bornheim L, Clary DO, Tai A, Wagner JM, Miller N, Kim YD: Фармакологическая отмена контрольной точки S-фазы усиливает противоопухолевую активность гемцитабин in vivo. Клеточный цикл. 2007, 6: 104-110.
Клеточный цикл. 2007, 6: 104-110.
КАС пабмед Статья Google Scholar
Tse AN, Rendahl KG, Sheikh T, Cheema H, Aardalen K, Embry M, Ma S, Moler EJ, Ni ZJ, Lopes de Menezes DE: CHIR-124, новый мощный ингибитор Chk1, потенцирует цитотоксичность ядов топоизомеразы I in vitro и in vivo. Клин Рак Рез. 2007, 13: 591-602. 10.1158/1078-0432.ККР-06-1424
КАС пабмед Статья Google Scholar
Бласина А., Халлин Дж., Чен Э., Аранго М.Е., Крайнов Э., Регистр Дж., Грант С., Нинкович С., Чен П., Николс Т.: нарушение контрольной точки повреждения ДНК с помощью PF-00477736, нового низкомолекулярного ингибитора киназы контрольной точки . Мол Рак Тер. 2008, 7: 2394-2404. 10.1158/1535-7163.MCT-07-2391
КАС пабмед Статья Google Scholar
Syljuasen RG, Sorensen CS, Nylandsted J, Lukas C, Lukas J, Bartek J: ингибирование Chk1 с помощью CEP-3891 ускоряет фрагментацию митотического ядра в ответ на ионизирующее излучение. Рак Рез. 2004, 64: 9035-9040. 10.1158/0008-5472.КАН-04-2434
Рак Рез. 2004, 64: 9035-9040. 10.1158/0008-5472.КАН-04-2434
КАС пабмед Статья Google Scholar
Li G, Hasvold LA, Tao ZF, Wang GT, Gwaltney SL, Patel J, Kovar P, Credo RB, Chen Z, Zhang H: Синтез и биологическая оценка 1-(2, 4, 5- тризамещенные фенил)-3-(5-цианопиразин-2-ил)мочевины в качестве мощных ингибиторов киназы Chk1. Bioorg Med Chem Lett. 2006, 16: 2293-2298. 10.1016/j.bmcl.2006.01.028
CAS пабмед Статья Google Scholar
Yu Q, La Rose J, Zhang H, Takemura H, Kohn KW, Pommier Y: UCN-01 ингибирует активацию p53 и отменяет контрольную точку G(2)-M, индуцированную гамма-излучением, независимо от p53, воздействуя на оба киназы контрольных точек, Chk2 и Chk1. Рак Рез. 2002, 62: 5743-5748.
КАС пабмед Google Scholar
Didier C, Cavelier C, Quaranta M, Galcera MO, Demur C, Laurent G, Manenti S, Ducommun B: строгость контрольной точки G2/M является ключевым параметром чувствительности клеток ОМЛ к генотоксическому стрессу. Онкоген. 2008, 27: 3811-3820. 10.1038/sj.onc.1211041
Онкоген. 2008, 27: 3811-3820. 10.1038/sj.onc.1211041
CAS пабмед Статья Google Scholar
Playle LC, Hicks DJ, Qualtrough D, Paraskeva C: Аннулирование радиационно-индуцированной контрольной точки G2 производным стауроспорина UCN-01 связано с радиосенсибилизацией в подгруппе клеточных линий колоректальной опухоли. Бр Дж Рак. 2002, 87: 352-358. 10.1038/sj.bjc.6600492
PubMed Central КАС пабмед Статья Google Scholar
Кортманский Дж., Шах М.А., Каубиш А., Вейербахер А., Йи С., Тонг В., Сауэрс Р., Гонен М., О’Рейли Э., Кемени Н.: Фаза I испытаний ингибитора циклинзависимой киназы и ингибитора протеинкиназы С 7- гидроксистауроспорин в комбинации с фторурацилом у пациентов с запущенными солидными опухолями. Дж. Клин Онкол. 2005, 23: 1875-1884. 10.1200/JCO.2005.03.116
КАС пабмед Статья Google Scholar

Hotte SJ, Oza A, Winquist EW, Moore M, Chen EX, Brown S, Pond GR, Dancey JE, Hirte HW: Фаза I испытания UCN-01 в комбинации с топотеканом у пациентов с распространенным солидным раком : исследование Консорциума фазы II больницы принцессы Маргарет.Энн Онкол. 2006, 17: 334-340. 10.1093/annonc/mdj076
CAS пабмед Статья Google Scholar
Lara PN, Mack PC, Synold T, Frankel P, Longmate J, Gumerlock PH, Doroshow JH, Gandara DR: Ингибитор циклинзависимой киназы UCN-01 плюс цисплатин при прогрессирующих солидных опухолях: Калифорнийский онкологический консорциум Фармакокинетическое и молекулярно-корреляционное исследование фазы I. Клин Рак Рез. 2005, 11: 4444-4450. 10.1158/1078-0432.CCR-04-2602
КАС пабмед Статья Google Scholar
Welch S, Hirte HW, Carey MS, Hotte SJ, Tsao MS, Brown S, Pond GR, Dancey JE, Oza AM: UCN-01 в комбинации с топотеканом у пациентов с прогрессирующим рецидивирующим раком яичников: исследование консорциума II фазы больницы принцессы Маргарет. Гинекол Онкол. 2007, 106: 305-310. 10.1016/j.ygyno.2007.02.018
Гинекол Онкол. 2007, 106: 305-310. 10.1016/j.ygyno.2007.02.018
КАС пабмед Статья Google Scholar
Edelman MJ, Bauer KS, Wu S, Smith R, Bisacia S, Dancey J: Фаза I и фармакокинетическое исследование 7-гидроксистауроспорина и карбоплатина при запущенных солидных опухолях. Клин Рак Рез. 2007, 13: 2667-2674. 10.1158/1078-0432.ККР-06-1832
КАС пабмед Статья Google Scholar
Хата Т., Фурукава Т., Сунамура М., Эгава С., Мотои Ф., Омура Н., Марумото Т., Сая Х., Хории А.: РНК-интерференция, направленная на авроракиназу а, подавляет рост опухоли и повышает химиочувствительность к таксанам в поджелудочной железе человека. раковые клетки.Рак Рез. 2005, 65: 2899-2905. 10.1158/0008-5472.КАН-04-3981
КАС пабмед Статья Google Scholar
Wang XX, Liu R, Jin SQ, Fan FY, Zhan QM: Сверхэкспрессия киназы Aurora-A способствует пролиферации опухолевых клеток и ингибирует апоптоз в клеточной линии плоскоклеточной карциномы пищевода. Сотовый рез. 2006, 16: 356-366. 10.1038/sj.cr.7310046
Сотовый рез. 2006, 16: 356-366. 10.1038/sj.cr.7310046
CAS пабмед Статья Google Scholar
Soncini C, Carpinelli P, Gianellini L, Fancelli D, Vianello P, Rusconi L, Storici P, Zugnoni P, Pesenti E, Croci V: PHA-680632, новый ингибитор киназы Aurora с мощной противоопухолевой активностью. Клин Рак Рез. 2006, 12: 4080-4089. 10.1158/1078-0432.ККР-05-1964
КАС пабмед Статья Google Scholar
Гонтаревич А., Балабанов С., Келлер Г., Коломбо Р., Грациано А., Пезенти Э., Бентен Д., Бокемейер С., Фидлер В., Молл Дж., Бруммендорф Т.Х.: Одновременное нацеливание на киназы Aurora и киназу Bcr-Abl с помощью низкомолекулярный ингибитор PHA-739358 эффективен против резистентных к иматинибу мутаций BCR-ABL, включая T315I.Кровь. 2008, 111: 4355-4364. 10.1182/кровь-2007-09-113175
CAS пабмед Статья Google Scholar

Агнесе В., Базан В., Фиорентино Ф.П., Фанале Д., Бадаламенти Г., Колуччи Г., Адамо В., Сантини Д., Руссо А. Роль ингибиторов Аврора-А в терапии рака. Энн Онкол. 2007, 18 (Приложение 6): vi47-52. 10.1093/annonc/mdm224
PubMed Google Scholar
Fiskus W, Wang Y, Joshi R, Rao R, Yang Y, Chen J, Kolhe R, Balusu R, Eaton K, Lee P: совместное лечение вориностатом повышает активность MK-0457 (VX-680) против острых и хронических миелогенных лейкозные клетки. Клин Рак Рез. 2008, 14: 6106-6115. 10.1158/1078-0432.CCR-08-0721
Центральный пабмед КАС пабмед Статья Google Scholar
Tao Y, Zhang P, Frascogna V, Lecluse Y, Auperin A, Bourhis J, Deutsch E: Усиление радиационного ответа путем ингибирования киназы Aurora-A с использованием siRNA или селективного ингибитора киназы Aurora PHA680632 в p53- дефицитные раковые клетки.Бр Дж Рак. 2007, 97: 1664-1672. 10.1038/sj.bjc.6604083
10.1038/sj.bjc.6604083
PubMed Central КАС пабмед Статья Google Scholar
Harrington EA, Bebbington D, Moore J, Rasmussen RK, Ajose-Adeogun AO, Nakayama T, Graham JA, Demur C, Hercend T, Diu-Hercend A: VX-680, мощный и селективный малый- молекулярный ингибитор киназ Aurora, подавляет рост опухоли in vivo. Нат Мед. 2004, 10: 262-267. 10.1038/нм1003
КАС пабмед Статья Google Scholar
Arlot-Bonnemains Y, Baldini E, Martin B, Delcros JG, Toller M, Curcio F, Ambesi-Impiombato FS, D’Armiento M, Ulisse S: Влияние ингибитора киназы Aurora VX-680 на клетки, полученные из анапластического рака щитовидной железы линии. Endocr Relat Рак. 2008, 15: 559-568. 10.1677/ERC-08-0021
КАС пабмед Статья Google Scholar
Лин Ю.Г., Имманени А., Мерритт В.М., Мангала Л. С., Ким С.В., Шахзад М.М., Цанг Ю.Т., Армаиз-Пена Г.Н., Лу С., Камат А.А.: воздействие на киназу аврора с помощью MK-0457 подавляет рост рака яичников.Клин Рак Рез. 2008, 14: 5437-5446. 10.1158/1078-0432.CCR-07-4922
С., Ким С.В., Шахзад М.М., Цанг Ю.Т., Армаиз-Пена Г.Н., Лу С., Камат А.А.: воздействие на киназу аврора с помощью MK-0457 подавляет рост рака яичников.Клин Рак Рез. 2008, 14: 5437-5446. 10.1158/1078-0432.CCR-07-4922
PubMed Central КАС пабмед Статья Google Scholar
Курихара Д., Мацунага С., Кавабе А., Фуджимото С., Нода М., Утияма С., Фукуи К.: киназа Aurora необходима для сегрегации хромосом в клетках табака BY-2. Плант Дж. 2006, 48: 572-580. 10.1111/j.1365-313X.2006.02893.x
CAS пабмед Статья Google Scholar
Ditchfield C, Johnson VL, Tighe A, Ellston R, Haworth C, Johnson T, Mortlock A, Keen N, Taylor SS: Aurora B связывает выравнивание хромосом с анафазой, нацеливая BubR1, Mad2 и Cenp-E на кинетохоры. Джей Селл Биол. 2003, 161: 267-280. 10.1083/jcb.200208091
PubMed Central КАС пабмед Статья Google Scholar

Walsby E, Walsh V, Pepper C, Burnett A, Mills K: Влияние ингибиторов киназы aurora AZD1152-HQPA и ZM447439 на остановку роста и полиплоидию в клеточных линиях острого миелоидного лейкоза и первичных бластах.Гематология. 2008, 93: 662-669. 10.3324/гематол.12148
CAS пабмед Статья Google Scholar
Long ZJ, Xu J, Yan M, Zhang JG, Guan Z, Xu DZ, Wang XR, Yao J, Zheng FM, Chu GL: ингибирование ZM 447439 киназы aurora вызывает апоптоз раковых клеток Hep2 в трех- объемная культура. Клеточный цикл. 2008, 7: 1473-1479.
КАС пабмед Статья Google Scholar
Cogswell JP, Brown CE, Bisi JE, Neill SD: Доминантно-отрицательная полоподобная киназа 1 вызывает митотическую катастрофу независимо от функции cdc25C. Рост клеток отличается. 2000, 11: 615-623.
КАС пабмед Google Scholar

Ногава М., Юаса Т., Кимура С., Танака М., Курода Дж., Сато К., Ёкота А., Сегава Х., Тода Й., Кагеяма С.: Внутрипузырное введение малой интерферирующей РНК, нацеленной на PLK-1, успешно предотвращает рост рака мочевого пузыря.Джей Клин Инвест. 2005, 115: 978-985.
Центральный пабмед КАС пабмед Статья Google Scholar
Yu C, Zhang X, Sun G, Guo X, Li H, You Y, Gardner K, Yuan D, Xu Z, Du Q: РНК-интерференция, опосредованная молчанием гена Polo-подобной киназы 1, усиливает Химиочувствительность к гемцитабину в клетках аденокарциномы поджелудочной железы. J Cell Mol Med. 2008, 12 (6А): 2334-49. 10.1111/j.1582-4934.2008.00257.x
PubMed Central КАС пабмед Статья Google Scholar
Strebhardt K, Ullrich A: Нацеливание на полоподобную киназу 1 для лечения рака. Нат Рев Рак. 2006, 6: 321-330. 10.1038/нрк1841
КАС пабмед Статья Google Scholar

Gumireddy K, Reddy MV, Cosenza SC, Boominathan R, Baker SJ, Papathi N, Jiang J, Holland J, Reddy EP: ON01910, низкомолекулярный ингибитор Plk1, не конкурирующий с АТФ, является мощным противораковое средство. Раковая клетка. 2005, 7: 275-286. 10.1016/j.ccr.2005.02.009
КАС пабмед Статья Google Scholar
Calin GA, Croce CM: Сигнатуры микроРНК при раке человека. Нат Рев Рак. 2006, 6: 857-866. 10.1038/nrc1997
КАС пабмед Статья Google Scholar
Lagos-Quintana M, Rauhut R, Lendeckel W, Tuschl T: Идентификация новых генов, кодирующих малые экспрессируемые РНК. Наука.2001, 294: 853-858. 10.1126/наука.1064921
CAS пабмед Статья Google Scholar
Volinia S, Calin GA, Liu CG, Ambs S, Cimmino A, Petrocca F, Visone R, Iorio M, Roldo C, Ferracin M: Сигнатура экспрессии микроРНК солидных опухолей человека определяет мишени раковых генов. Proc Natl Acad Sci USA. 2006, 103: 2257-2261. 10.1073/pnas.0510565103
Proc Natl Acad Sci USA. 2006, 103: 2257-2261. 10.1073/pnas.0510565103
PubMed Central КАС пабмед Статья Google Scholar
Чиммино А., Калин Г.А., Фаббри М., Иорио М.В., Феррацин М., Симидзу М., Войцик С.Е., Акейлан Р.И., Зупо С., Доно М.: миР-15 и миР-16 индуцируют апоптоз путем нацеливания на BCL2. Proc Natl Acad Sci USA. 2005, 102: 13944-13949. 10.1073/pnas.0506654102
PubMed Central КАС пабмед Статья Google Scholar
Mertens-Talcott SU, Chintharlapalli S, Li X, Safe S: Онкогенная микроРНК-27a нацелена на гены, которые регулируют факторы транскрипции белков специфичности и контрольную точку G2-M в клетках рака молочной железы MDA-MB-231.Рак Рез. 2007, 67: 11001-11011. 10.1158/0008-5472.КАН-07-2416
КАС пабмед Статья Google Scholar
Yang H, Kong W, He L, Zhao JJ, O’Donnell JD, Wang J, Wenham RM, Coppola D, Kruk PA, Nicosia SV, Cheng JQ: Профилирование экспрессии микроРНК при раке яичников человека: miR -214 индуцирует выживаемость клеток и устойчивость к цисплатину путем нацеливания на PTEN. Рак Рез. 2008, 68: 425-433. 10.1158/0008-5472.КАН-07-2488
Рак Рез. 2008, 68: 425-433. 10.1158/0008-5472.КАН-07-2488
КАС пабмед Статья Google Scholar
Tazawa H, Tsuchiya N, Izumiya M, Nakagama H: опухолесупрессирующая миР-34a вызывает остановку роста, подобную старению, посредством модуляции пути E2F в клетках рака толстой кишки человека. Proc Natl Acad Sci USA. 2007, 104: 15472-15477. 10.1073/pnas.0707351104
PubMed Central КАС пабмед Статья Google Scholar
Чжан Л., Кукос Г.: МикроРНК: новое понимание генома рака. Клеточный цикл. 2006, 5: 2216-2219.
КАС пабмед Статья Google Scholar
Карлтон М., Клири М.А., Линсли П.С.: МикроРНК и регуляция клеточного цикла. Клеточный цикл. 2007, 6: 2127-2132.
КАС пабмед Статья Google Scholar

Резенде Р.А., Бисол Т., Хаммерсмит К., Рапуано С.Дж., Лима А.Л., Вебстер Г.Ф., Фрейтас Дж.Ф., Лайбсон П.Р., Коэн Э.Дж.: Эффективность пероральной противовирусной профилактики в предотвращении рецидивов вируса простого герпеса у пациентов с и без самооценка атопии.Am J Офтальмол. 2006, 142: 563-567. 10.1016/j.ajo.2006.05.025
CAS пабмед Статья Google Scholar
Thomson JM, Newman M, Parker JS, Morin-Kensicki EM, Wright T, Hammond SM: Обширная посттранскрипционная регуляция микроРНК и ее последствия для рака. Гены Дев. 2006, 20: 2202-2207. 10.1101/гад.1444406
PubMed Central КАС пабмед Статья Google Scholar
Кумар М.С., Лу Дж., Мерсер К.Л., Голуб Т.Р., Джекс Т.: Нарушение процессинга микроРНК усиливает клеточную трансформацию и онкогенез. Нат Жене. 2007, 39: 673-677. 10.1038/нг2003
КАС пабмед Статья Google Scholar

Yang N, Kaur S, Volinia S, Greshock J, Lassus H, Hasegawa K, Liang S, Leminen A, Deng S, Smith L: микрочип микроРНК идентифицирует Let-7i как новый биомаркер и терапевтическую мишень в эпителиальный рак яичников человека.Рак Рез. 2008, 68: 10307-10314. 10.1158/0008-5472.CAN-08-1954
Центр ПабМед КАС пабмед Статья Google Scholar
Исии Х., Ивацуки М., Иета К., Охта Д., Харагучи Н., Мимори К., Мори М.: Раковые стволовые клетки и устойчивость к химиоизлучению. Онкологические науки. 2008, 99: 1871-1877.
КАС пабмед Статья Google Scholar
O’Brien CA, Pollett A, Gallinger S, Dick JE: раковая клетка толстой кишки человека, способная инициировать рост опухоли у мышей с иммунодефицитом.Природа. 2007, 445: 106-110. 10.1038/nature05372
PubMed Статья КАС Google Scholar

Schatton T, Frank MH: Раковые стволовые клетки и злокачественная меланома человека. Пигментно-клеточная меланома Res. 2008, 21: 39-55. 10.1111/j.1755-148X.2007.00427.x
PubMed Central КАС пабмед Статья Google Scholar
Hermann PC, Huber SL, Herrler T, Aicher A, Ellwart JW, Guba M, Bruns CJ, Heeschen C: Различные популяции раковых стволовых клеток определяют рост опухоли и метастатическую активность при раке поджелудочной железы человека.Клеточная стволовая клетка. 2007, 1: 313-323. 10.1016/j.stem.2007.06.002
CAS пабмед Статья Google Scholar
Wright MH, Calcagno AM, Salcido CD, Carlson MD, Ambudkar SV, Varticovski L: Опухоли молочной железы Brca1 содержат различные CD44+/CD24- и CD133+ клетки с характеристиками раковых стволовых клеток. Рак молочной железы Res. 2008, 10: R10- 10.1186/bcr1855
PubMed Central пабмед Статья КАС Google Scholar

Patrawala L, Calhoun T, Schneider-Broussard R, Li H, Bhatia B, Tang S, Reilly JG, Chandra D, Zhou J, Claypool K: Высокоочищенные клетки рака предстательной железы CD44+ из ксенотрансплантатов опухолей человека обогащены онкогенными и метастатическими предшественниками клетки. Онкоген. 2006, 25: 1696-1708. 10.1038/sj.onc.1209327
CAS пабмед Статья Google Scholar
Wu A, Oh S, Wiesner SM, Ericson K, Chen L, Hall WA, Champoux PE, Low WC, Ohlfest JR: Сохранение клеток CD133+ в клеточных линиях глиомы человека и мыши: подробная характеристика глиомы GL261 клетки со свойствами раковых стволовых клеток.Стволовые клетки Dev. 2008, 17: 173-184. 10.1089/scd.2007.0133
CAS пабмед Статья Google Scholar
Chumsri S, Burger AM: Агенты, нацеленные на раковые стволовые клетки: терапевтические подходы и последствия. Curr Opin Mol Ther. 2008, 10: 323-333.
КАС пабмед Google Scholar
Дремлющее происхождение, контрольная точка лицензирования и реакция на репликативный стресс
- Дебби Макинтош и
- Дж.Джулиан Блоу
- Центр регуляции и экспрессии генов, Университет Данди, Доу-Стрит, Данди DD1 5EH, Соединенное Королевство
- Адрес для переписки: j.j.blow{at}dundee.ac.uk
Аннотация
Только ∼10% источников репликации, которые лицензируются путем загрузки комплексов обслуживания минихромосом 2-7 (MCM2-7), обычно являются
используются, а большинство остается бездействующим. Если развитие репликационной вилки подавлено, близлежащие бездействующие источники инициируют
убедиться, что вся хромосомная ДНК реплицирована. В то же время активируются киназы реакции на повреждение ДНК, которые предпочтительно
подавлять сборку новых фабрик репликации. Это отвлекает события инициации от совершенно новых областей генома.
к областям, испытывающим репликативный стресс. Мыши, гипоморфные по MCM2-7, которые в ответ активируют меньше спящих источников
к ингибированию репликации, склонны к раку и генетически нестабильны.Контрольно-пропускной пункт для лицензирования задерживает вход в фазу S
если было лицензировано недостаточное количество источников. Напротив, люди с синдромом Мейера-Горлина имеют мутации в
pre-RC белки и обнаруживают дефекты клеточной пролиферации, которые могут быть следствием хронической активации контрольной точки лицензирования.
Если развитие репликационной вилки подавлено, близлежащие бездействующие источники инициируют
убедиться, что вся хромосомная ДНК реплицирована. В то же время активируются киназы реакции на повреждение ДНК, которые предпочтительно
подавлять сборку новых фабрик репликации. Это отвлекает события инициации от совершенно новых областей генома.
к областям, испытывающим репликативный стресс. Мыши, гипоморфные по MCM2-7, которые в ответ активируют меньше спящих источников
к ингибированию репликации, склонны к раку и генетически нестабильны.Контрольно-пропускной пункт для лицензирования задерживает вход в фазу S
если было лицензировано недостаточное количество источников. Напротив, люди с синдромом Мейера-Горлина имеют мутации в
pre-RC белки и обнаруживают дефекты клеточной пролиферации, которые могут быть следствием хронической активации контрольной точки лицензирования.
Репликация большого количества ДНК в эукариотических клетках — сложная задача, требующая активации сотен или тысяч
происхождения распространяется по всему геному.Для поддержания генетической стабильности важно, чтобы во время фазы S геномная ДНК
точно продублированы, ни один участок ДНК не остался нереплицированным и ни один участок ДНК не реплицировался более одного раза. Предотвращать
повторной репликации клетки делят процесс репликации ДНК на две непересекающиеся фазы. До фазы S источники
лицензируется связыванием двойных гексамеров минихромосомы 2-7 (MCM2-7) (Gillespie et al. 2001; Blow and Dutta 2005; Arias and Walter 2007).Во время S фазы они активируются как ядро репликативной хеликазы CMG (Cdc45-MCM-GINS) (Moyer et al. 2006; Ilves et al. 2010). Перед началом S-фазы лицензионные белки подавляются или ингибируются, так что больше нельзя лицензировать происхождение. (Wohlschlegel et al. 2000; Tada et al. 2001; Li et al. 2003; Li and Blow 2005). Одним из следствий использования этого механизма для предотвращения повторной репликации ДНК является необходимость наличия достаточного количества ориджинов.
лицензируются до вступления в S-фазу, так что ни одна область генома не остается нереплицированной, даже если некоторые ответвления репликации
остановка или некоторые источники не могут инициироваться (Blow et al.2011). Клетки Metazoan используют контрольную точку лицензирования, чтобы контролировать, что достаточное количество источников лицензировано, подавляя вход в S-фазу.
пока это не будет установлено (Shreeram et al. 2002; Blow and Gillespie 2008).
(Wohlschlegel et al. 2000; Tada et al. 2001; Li et al. 2003; Li and Blow 2005). Одним из следствий использования этого механизма для предотвращения повторной репликации ДНК является необходимость наличия достаточного количества ориджинов.
лицензируются до вступления в S-фазу, так что ни одна область генома не остается нереплицированной, даже если некоторые ответвления репликации
остановка или некоторые источники не могут инициироваться (Blow et al.2011). Клетки Metazoan используют контрольную точку лицензирования, чтобы контролировать, что достаточное количество источников лицензировано, подавляя вход в S-фазу.
пока это не будет установлено (Shreeram et al. 2002; Blow and Gillespie 2008).
Здесь мы рассматриваем недавнее исследование, показывающее, как клетки обеспечивают полную дупликацию генома, лицензируя большее количество источников репликации.
в G1, чем обычно используются во время фазы S. Бездействующие в противном случае источники репликации становятся важными для обеспечения завершения
репликации ДНК, если вилки репликации останавливаются или ингибируются во время S-фазы.Мы также рассматриваем исследования, показывающие, как лицензирование
контрольная точка гарантирует, что достаточно большое количество источников будет лицензировано до того, как ячейки перейдут к S-фазе.
Бездействующие в противном случае источники репликации становятся важными для обеспечения завершения
репликации ДНК, если вилки репликации останавливаются или ингибируются во время S-фазы.Мы также рассматриваем исследования, показывающие, как лицензирование
контрольная точка гарантирует, что достаточно большое количество источников будет лицензировано до того, как ячейки перейдут к S-фазе.
СПЯЩИЕ ИСТОЧНИКИ РЕПЛИКАЦИИ
комплекса MCM2-7 наносят на ДНК в избытке по сравнению с обычно используемым количеством, при этом только ~10% используется в невозмущенном
S-фаза (Burkhart et al.1995 год; Донован и др. 1997 год; Махбубани и др. 1997 год; Блоу и др. 2011 г.; Вонг и др. 2011). Остальные обычно остаются бездействующими и пассивно воспроизводятся приближающимися разветвлениями (Woodward et al. 2006; Ge et al. 2007). Спящие источники полностью способны к инициации, но не являются существенными для нормального развития S-фазы (Woodward et al. 2006). Существование этих неактивных источников означает, что использование источников может меняться в зависимости от обстоятельств. Уровни связанных с хроматином
Количество MCM2-7 может быть снижено в несколько раз в экстрактах яиц Xenopus , C.elegans и в клеточных линиях человека, не оказывая существенного влияния на общую скорость репликации (Mahbubani et al. 1997; Edwards et al. 2002; Oehlmann et al. 2004; Ge et al. 2007; Ibarra et al. 2008). Однако эти «минимально лицензированные» клетки не могут завершить репликацию при воздействии экзогенного репликативного стресса.
предполагая роль спящих источников в преодолении таких стрессов (Woodward et al. 2006; Ge et al. 2007; Ibarra et al. 2008).
2006; Ge et al. 2007). Спящие источники полностью способны к инициации, но не являются существенными для нормального развития S-фазы (Woodward et al. 2006). Существование этих неактивных источников означает, что использование источников может меняться в зависимости от обстоятельств. Уровни связанных с хроматином
Количество MCM2-7 может быть снижено в несколько раз в экстрактах яиц Xenopus , C.elegans и в клеточных линиях человека, не оказывая существенного влияния на общую скорость репликации (Mahbubani et al. 1997; Edwards et al. 2002; Oehlmann et al. 2004; Ge et al. 2007; Ibarra et al. 2008). Однако эти «минимально лицензированные» клетки не могут завершить репликацию при воздействии экзогенного репликативного стресса.
предполагая роль спящих источников в преодолении таких стрессов (Woodward et al. 2006; Ge et al. 2007; Ibarra et al. 2008).
Репликационные вилки могут быть ингибированы либо воздействием экзогенных ингибиторов, либо когда они сталкиваются с препятствиями, такими как белки
прочно связаны с ДНК, химически модифицированными основаниями или разрывами цепей ДНК. Часто проблемы можно преодолеть, а заторможенное
вилки могут возобновить синтез ДНК. Однако бывают случаи, когда вилки репликации необратимо рушатся, что может быть связано с
с разборкой реплисомных белков из ДНК (Sirbu et al. 2011). Поскольку новое происхождение не может быть лицензировано после входа в фазу S, ячейки должны полагаться на ранее лицензированное происхождение, чтобы преодолеть
Эта проблема. Вилки репликации движутся в обоих направлениях, а это означает, что если одна вилка останавливается, вилка идет от противоположной стороны.
направление может спасти это (рис.1А,Б). Однако, когда две сходящиеся вилки останавливаются, геном между ними остается в скомпрометированном состоянии, и если нет
бездействующем происхождении между остановившимися разветвлениями, завершение репликации ДНК будет затруднено (Fig. 1C), возможно, в зависимости от зависимого от рекомбинации перезапуска разветвления (Blow et al.
Часто проблемы можно преодолеть, а заторможенное
вилки могут возобновить синтез ДНК. Однако бывают случаи, когда вилки репликации необратимо рушатся, что может быть связано с
с разборкой реплисомных белков из ДНК (Sirbu et al. 2011). Поскольку новое происхождение не может быть лицензировано после входа в фазу S, ячейки должны полагаться на ранее лицензированное происхождение, чтобы преодолеть
Эта проблема. Вилки репликации движутся в обоих направлениях, а это означает, что если одна вилка останавливается, вилка идет от противоположной стороны.
направление может спасти это (рис.1А,Б). Однако, когда две сходящиеся вилки останавливаются, геном между ними остается в скомпрометированном состоянии, и если нет
бездействующем происхождении между остановившимися разветвлениями, завершение репликации ДНК будет затруднено (Fig. 1C), возможно, в зависимости от зависимого от рекомбинации перезапуска разветвления (Blow et al._000035.gif) 2011). Однако, если между застопорившимися ответвлениями активируется спящий источник, это обеспечивает простой механизм репликации.
вся промежуточная ДНК (рис. 1D) (Woodward et al.2006 г.; Ге и др. 2007).
2011). Однако, если между застопорившимися ответвлениями активируется спящий источник, это обеспечивает простой механизм репликации.
вся промежуточная ДНК (рис. 1D) (Woodward et al.2006 г.; Ге и др. 2007).
Влияние остановки вилки на завершение репликации. Небольшой сегмент хромосомной ДНК показан с двумя эффективными лицензированными
происхождения (красные гексамеры) плюс необязательный бездействующий источник (зеленые гексамеры). Остановка вилки обозначается вертикальной фиолетовой полосой.
( A ) Одна вилка останавливается, но вся промежуточная ДНК реплицируется вилкой, происходящей из соседнего источника.( B ) Спящий источник инактивируется развилкой, идущей справа. ( C ) Каждая из двух сходящихся вилок останавливается без неактивного начала между ними. Репликация не может быть завершена, так как нет
новые комплексы MCM2-7 могут быть загружены на ДНК после начала S-фазы. ( D ) Две сходящиеся вилки останавливаются, но бездействующий источник между ними позволяет завершить репликацию.
Репликация не может быть завершена, так как нет
новые комплексы MCM2-7 могут быть загружены на ДНК после начала S-фазы. ( D ) Две сходящиеся вилки останавливаются, но бездействующий источник между ними позволяет завершить репликацию.
Точный механизм регуляции спящих источников неясен.Уже много лет известно, что в ответ на замедление вилки
внутри кластеров наблюдается повышенная плотность происхождения (Оки и Саффхилл, 1976; Тейлор, 1977; Фрэнсис и др., 1985; Гриффитс и Линг, 1985; Англана и др., 2003; Ге и др., 2007; Гилберт, 2007; Блоу и др., 2011; Borowiec and Schildkraut 2011; Karnani and Dutta 2011), указывая на то, что в этих скоплениях активизировались спящие источники. Вполне вероятно, что выстрелы определенного происхождения в пределах одного
кластер представляет собой стохастический процесс, который может объяснить наблюдаемые различия в использовании происхождения от клетки к клетке (Anglana et al. 2003 г.; Блоу и Ге, 2009 г.; Боровец и Шильдкраут, 2011). Поскольку лицензированные источники инактивируются, когда они пассивно реплицируются встречными форками, они обычно инактивируются.
прежде чем они успеют начать. Следовательно, снижение скорости удлинения вилки увеличивает время до инактивации.
спящих источников, увеличивая вероятность того, что они будут инициированы. Компьютерное моделирование исходного кластера размером 250 КБ показало
что стохастическое срабатывание очагов может обеспечить хорошее приближение к наблюдаемым образцам спящего возбудителя, если есть
на каждый источник, активирующийся в ненапряженных условиях, приходится около 3 спящих источников (Blow and Ge 2009).Модель также показывает, как бездействующие источники могут позволить завершить репликацию, даже если некоторые ответвления необратимо остановятся. Этот
дает простое объяснение того, как регулируется срабатывание источника репликации, что одновременно обеспечивает защиту от
репликативный стресс при минимизации затрат на использование большого количества репликационных вилок (Blow and Ge 2009; Blow et al.
2003 г.; Блоу и Ге, 2009 г.; Боровец и Шильдкраут, 2011). Поскольку лицензированные источники инактивируются, когда они пассивно реплицируются встречными форками, они обычно инактивируются.
прежде чем они успеют начать. Следовательно, снижение скорости удлинения вилки увеличивает время до инактивации.
спящих источников, увеличивая вероятность того, что они будут инициированы. Компьютерное моделирование исходного кластера размером 250 КБ показало
что стохастическое срабатывание очагов может обеспечить хорошее приближение к наблюдаемым образцам спящего возбудителя, если есть
на каждый источник, активирующийся в ненапряженных условиях, приходится около 3 спящих источников (Blow and Ge 2009).Модель также показывает, как бездействующие источники могут позволить завершить репликацию, даже если некоторые ответвления необратимо остановятся. Этот
дает простое объяснение того, как регулируется срабатывание источника репликации, что одновременно обеспечивает защиту от
репликативный стресс при минимизации затрат на использование большого количества репликационных вилок (Blow and Ge 2009; Blow et al. 2011). В соответствии с этой интерпретацией существует корреляция между степенью замедления вилки и общим увеличением
исходной плотности (Ge et al.2007 г.; Курбе и др. 2008).
2011). В соответствии с этой интерпретацией существует корреляция между степенью замедления вилки и общим увеличением
исходной плотности (Ge et al.2007 г.; Курбе и др. 2008).
Хотя возбуждение в состоянии покоя может возникать как следствие чисто стохастических процессов, вполне вероятно, что оно также модулируется.
другими регуляторными механизмами. В ответ на остановку вилки активируются киназы повреждения ДНК ATR и Chk1 (Branzei and Foiani 2005; Lambert and Carr 2005). Ингибирование ATR или Chk1 приводит к увеличению плотности происхождения даже в отсутствие стресса (Miao et al.2003 г.; Мархейнеке и Хириен, 2004 г.; Сильюасен и др. 2005 г.; Вудворд и др. 2006 г.; Ге и др. 2007 г.; Карнани и Датта, 2011). Одно из объяснений такого поведения состоит в том, что спящие источники активируются в результате повышенного зависания вилки, которое
происходит при отсутствии нормальной активности ATR и Chk1 (Zachos et al. 2003). Однако также возможно, что низкие уровни ATR/Chk1 активны даже в отсутствие экзогенных репликативных стрессов,
играют роль в подавлении дремлющих истоков.Кроме того, низкий уровень Chk1 преимущественно подавляет возбуждение нового происхождения в
кластеры, которые еще не участвовали в репликации, что дает неактивным источникам возможность инициировать в кластерах, где вилка останавливается
произошло (см. следующий раздел).
2003). Однако также возможно, что низкие уровни ATR/Chk1 активны даже в отсутствие экзогенных репликативных стрессов,
играют роль в подавлении дремлющих истоков.Кроме того, низкий уровень Chk1 преимущественно подавляет возбуждение нового происхождения в
кластеры, которые еще не участвовали в репликации, что дает неактивным источникам возможность инициировать в кластерах, где вилка останавливается
произошло (см. следующий раздел).
После того, как клетки прошли S-фазу в присутствии репликативных стрессов, есть доказательства того, что использование ориджинов
на следующей S-фазе изменится (Courbet et al.2008). После выращивания клеток в условиях, когда вилки могли двигаться лишь медленно, что способствовало высокой скорости инициации при
бездействующие клетки были синхронизированы в митозе и повторно пересеяны в свежую среду, что обеспечило быструю прогрессию разветвления. В
первой S-фазе после повторного посева общая плотность инициации упала, как и ожидалось по описанному стохастическому механизму.
выше. Когда исследовали конкретный локус вокруг гена AMPD, инициация не происходила преимущественно при нормальных условиях.
наиболее эффективное происхождение, oriGNAI3, но было распространено среди неактивных источников, а также oriGNAI3.Только во втором
В фазе S после увеличения скорости вилки было восстановлено доминирование oriGNAI3 и относительная эффективность бездействующего
происхождения уменьшилось. Следовательно, оказывается, что клетки приобретают память о спящем происхождении и могут адаптироваться к репликативному стрессу.
за счет повышения эффективности источников, которые обычно бездействуют (менее эффективны) (Blow and Ge 2008; Courbet et al. 2008).
В
первой S-фазе после повторного посева общая плотность инициации упала, как и ожидалось по описанному стохастическому механизму.
выше. Когда исследовали конкретный локус вокруг гена AMPD, инициация не происходила преимущественно при нормальных условиях.
наиболее эффективное происхождение, oriGNAI3, но было распространено среди неактивных источников, а также oriGNAI3.Только во втором
В фазе S после увеличения скорости вилки было восстановлено доминирование oriGNAI3 и относительная эффективность бездействующего
происхождения уменьшилось. Следовательно, оказывается, что клетки приобретают память о спящем происхождении и могут адаптироваться к репликативному стрессу.
за счет повышения эффективности источников, которые обычно бездействуют (менее эффективны) (Blow and Ge 2008; Courbet et al. 2008).
Использование спящих истоков, вероятно, обеспечивает первую линию защиты от замедления удлинения вилки и остановки вилки. То
Важность дремлющего происхождения в обеспечении стабильности генома была показана их ролью в подавлении онкогенеза. мышей
гипоморфные для MCM2 или MCM4 имеют пониженные уровни MCM2-7, связанных с хроматином, что приводит к уменьшению количества
спящего происхождения (Пруитт и др., 2007; Шима и др., 2007; Куннев и др., 2010; Кавабата и др., 2011; Клотц-Ноак и Блоу, 2011). Клетки гипоморфных мышей MCM страдают от повышенного срыва вилки и увеличения фокусов Rad51 и FancD2, что свидетельствует о
Повреждение ДНК даже при отсутствии экзогенного стресса (Куннев и соавт.2010 г.; Кавабата и др. 2011). Эти мыши не в состоянии нормально справляться со спонтанными повреждениями, вызванными эндогенными факторами, и это, вероятно, объясняет их
резкое увеличение опухолевого образования. Это говорит о том, что спящие источники играют важную роль в качестве супрессоров опухолей и что
неспособность активировать дремлющие ориджины в ответ на эндогенные репликативные стрессы может привести к повреждению ДНК и образованию опухолей.
То
Важность дремлющего происхождения в обеспечении стабильности генома была показана их ролью в подавлении онкогенеза. мышей
гипоморфные для MCM2 или MCM4 имеют пониженные уровни MCM2-7, связанных с хроматином, что приводит к уменьшению количества
спящего происхождения (Пруитт и др., 2007; Шима и др., 2007; Куннев и др., 2010; Кавабата и др., 2011; Клотц-Ноак и Блоу, 2011). Клетки гипоморфных мышей MCM страдают от повышенного срыва вилки и увеличения фокусов Rad51 и FancD2, что свидетельствует о
Повреждение ДНК даже при отсутствии экзогенного стресса (Куннев и соавт.2010 г.; Кавабата и др. 2011). Эти мыши не в состоянии нормально справляться со спонтанными повреждениями, вызванными эндогенными факторами, и это, вероятно, объясняет их
резкое увеличение опухолевого образования. Это говорит о том, что спящие источники играют важную роль в качестве супрессоров опухолей и что
неспособность активировать дремлющие ориджины в ответ на эндогенные репликативные стрессы может привести к повреждению ДНК и образованию опухолей.
РЕПЛИКАЦИОННЫЕ ЗАВОДЫ
В клетках многоклеточных животных кластеры 2–5 соседних источников инициируются одновременно во время S фазы (Jackson and Pombo 1998; Gillespie and Blow 2010).Один или несколько кластеров организованы в домены ДНК, содержащие ∼1 Мб ДНК и примерно 6–12 репликонов, каждый репликон обычно
тиражирование 50–150 т.п.н. Различные кластеры источников инициируются в разное время на протяжении S-фазы, что приводит к
программе (Димитрова и Гилберт, 1999; Цинк, 2006). ДНК внутри каждого домена можно визуализировать как отдельные фокусы, тысячи которых можно визуализировать во время каждой S-фазы.
Когда каждый фокус активируется для репликации, он связывается с белками репликации, образуя фабрику репликации.
(Хозак и др. 1993 год; Леонхардт и др. 2000 г.; Китамура и др. 2006). Ранние фабрики S-фазы имеют одинаковый размер с диаметром примерно 150 нм, и такое же количество обнаружено в
все ранние ядра S-фазы (Blow et al. 2011). В настоящее время неизвестно, являются ли фабрики физическими структурами, в которых вилочные белки организованы в надстройку.
или очаги образовались в результате организации ДНК в структуру хроматина более высокого порядка.
1993 год; Леонхардт и др. 2000 г.; Китамура и др. 2006). Ранние фабрики S-фазы имеют одинаковый размер с диаметром примерно 150 нм, и такое же количество обнаружено в
все ранние ядра S-фазы (Blow et al. 2011). В настоящее время неизвестно, являются ли фабрики физическими структурами, в которых вилочные белки организованы в надстройку.
или очаги образовались в результате организации ДНК в структуру хроматина более высокого порядка.
Недавно было показано, что эти фабрики регулируются в ответ на репликативный стресс.В ответ на низкий уровень
репликативного стресса происходит увеличение числа репликационных вилок на фабрику, что соответствует активации
спящего происхождения (Ge and Blow 2010). Это увеличение инициации приводит к увеличению плотности разветвления, наблюдаемому при анализе волокон ДНК. Если общая скорость репликации
доменов ДНК было уменьшено за счет ингибирования репликационной вилки, и если скорость, с которой активируются новые фабрики, должна была оставаться
постоянным, результатом должно стать увеличение числа активных фабрик. Однако на деле наблюдается обратное:
ингибирование репликационных вилок вызывает сокращение числа активных фабрик (Cseresnyes et al. 2009; Ge and Blow 2010). Эксперименты по изучению динамики фабрик после подавления репликационных вилок показали, что сокращение количества фабрик
является результатом снижения скорости активации новых фабрик репликации и зависит от Chk1 (Fig. 2) (Ge and Blow 2010). ATR активируется в ответ на замедление разветвления или остановку и, в свою очередь, активирует активность киназы Chk1 (Branzei and Foiani 2005; Lambert and Carr 2005).Преимущественно ингибируя активацию новых фабрик репликации, Chk1 подавляет активацию ориджинов в кластерах.
еще не начал репликацию, но позволяет активировать бездействующие источники в реплицирующихся кластерах, которые могли столкнуться с репликацией.
стресс (Ге и Блоу, 2010; Блоу и др., 2011).
Однако на деле наблюдается обратное:
ингибирование репликационных вилок вызывает сокращение числа активных фабрик (Cseresnyes et al. 2009; Ge and Blow 2010). Эксперименты по изучению динамики фабрик после подавления репликационных вилок показали, что сокращение количества фабрик
является результатом снижения скорости активации новых фабрик репликации и зависит от Chk1 (Fig. 2) (Ge and Blow 2010). ATR активируется в ответ на замедление разветвления или остановку и, в свою очередь, активирует активность киназы Chk1 (Branzei and Foiani 2005; Lambert and Carr 2005).Преимущественно ингибируя активацию новых фабрик репликации, Chk1 подавляет активацию ориджинов в кластерах.
еще не начал репликацию, но позволяет активировать бездействующие источники в реплицирующихся кластерах, которые могли столкнуться с репликацией.
стресс (Ге и Блоу, 2010; Блоу и др., 2011).

Модель реакции клеток на низкий уровень репликативного стресса.Два соседних кластера происхождения (фабрики, ограниченные желтым кружки) показаны на одном фрагменте ДНК (черные линии). При нормальных обстоятельствах ( осталось ) верхняя фабрика активируется немного раньше, чем нижняя фабрика, и каждая из них инициирует три происхождения. Под низким уровнем репликативного стресса ( справа ), репликационные вилки ингибируются в более раннем реплицирующемся кластере, что способствует активизации дремлющих ориджинов как прямой следствие стохастического происхождения срабатывания.Репликативный стресс активирует киназы контрольных точек повреждения ДНК, которые предпочтительно запретить активацию незадействованных более поздних кластеров/новых фабрик.
Очень мало известно о том, как регулируются фабрики репликации, и в настоящее время неизвестно, как Chk1 может различать
между активными кластерами и теми, которые уже реплицируются. Активация новых фабрик очень чувствительна к различным циклинзависимым
киназная (CDK) активность. Когда активность ЦДК снижали с помощью препарата росковитин, количество заводов также уменьшалось.
(Томсон и др., 2010). Для объяснения этого эффекта были предложены две разные возможности (Ге и Блоу, 2010; Гиллеспи и Блоу, 2010; Томсон и др., 2010; Блоу и др., 2011). CDK напрямую необходимы для срабатывания отдельных источников репликации, и возможно, что срабатывание первого
источник внутри кластера может распространить изменение по всему кластеру, чтобы облегчить инициацию в других источниках внутри кластера.
кластер.Снижение уровня CDK снизит общую скорость инициации и тем самым уменьшит активацию новых заводов.
Нисходящие мишени Chk1, такие как p53 и Cdc25, могут снижать активность CDK и тем самым снижать скорость активации новых
заводы. Альтернативная возможность состоит в том, что активность CDK играет непосредственную роль в регуляции фабрики путем фосфорилирования специфичных для фабрики
субстраты (например, белки, участвующие в ремоделировании хроматина), отличные от субстратов, необходимых для
стрельба по индивидуальному происхождению.
Активация новых фабрик очень чувствительна к различным циклинзависимым
киназная (CDK) активность. Когда активность ЦДК снижали с помощью препарата росковитин, количество заводов также уменьшалось.
(Томсон и др., 2010). Для объяснения этого эффекта были предложены две разные возможности (Ге и Блоу, 2010; Гиллеспи и Блоу, 2010; Томсон и др., 2010; Блоу и др., 2011). CDK напрямую необходимы для срабатывания отдельных источников репликации, и возможно, что срабатывание первого
источник внутри кластера может распространить изменение по всему кластеру, чтобы облегчить инициацию в других источниках внутри кластера.
кластер.Снижение уровня CDK снизит общую скорость инициации и тем самым уменьшит активацию новых заводов.
Нисходящие мишени Chk1, такие как p53 и Cdc25, могут снижать активность CDK и тем самым снижать скорость активации новых
заводы. Альтернативная возможность состоит в том, что активность CDK играет непосредственную роль в регуляции фабрики путем фосфорилирования специфичных для фабрики
субстраты (например, белки, участвующие в ремоделировании хроматина), отличные от субстратов, необходимых для
стрельба по индивидуальному происхождению. Эти специфичные для фабрики субстраты могут затем напрямую ингибироваться Chk1 в ответ на
репликативные стрессы (Ге и Блоу, 2010; Гиллеспи и Блоу, 2010; Томсон и др., 2010; Блоу и др., 2011).
Эти специфичные для фабрики субстраты могут затем напрямую ингибироваться Chk1 в ответ на
репликативные стрессы (Ге и Блоу, 2010; Гиллеспи и Блоу, 2010; Томсон и др., 2010; Блоу и др., 2011).
Регулирование репликации на заводском уровне важно для обеспечения полной репликации генома. От
предпочтительнее подавляя активацию новых фабрик репликации, Chk1 все еще может позволять спящим источникам запускаться стохастически
на предприятиях, испытывающих репликативный стресс.Это эффективно направляет репликационную активность в области генома.
сталкиваясь со стрессом, активируя спящие истоки на фабриках, где вилки сталкиваются с проблемами. Правильное регулирование
этого процесса требует надлежащего функционирования ответов контрольных точек ДНК и клеточного цикла. Поскольку эти системы часто
скомпрометированные в раковых клетках, они могут быть неспособны правильно регулировать спящие ориджины и фабрики репликации при репликации. ход вилки тормозится.Возможно, этим можно объяснить чувствительность некоторых раковых клеток к химиотерапевтическим препаратам.
препараты, воздействующие на процесс репликации ДНК (Blow and Gillespie, 2008; Blow et al., 2011). Также возможно, что хрупкие участки хромосом, которые склонны к поломке в результате отказа вилки репликации,
представляют регионы, в которых спящие источники либо неэффективно лицензируются, либо неэффективно активируются (Letessier et al., 2011; Ozeri-Galai et al., 2011; Debatisse et al.2012).
ход вилки тормозится.Возможно, этим можно объяснить чувствительность некоторых раковых клеток к химиотерапевтическим препаратам.
препараты, воздействующие на процесс репликации ДНК (Blow and Gillespie, 2008; Blow et al., 2011). Также возможно, что хрупкие участки хромосом, которые склонны к поломке в результате отказа вилки репликации,
представляют регионы, в которых спящие источники либо неэффективно лицензируются, либо неэффективно активируются (Letessier et al., 2011; Ozeri-Galai et al., 2011; Debatisse et al.2012).
ЛИЦЕНЗИОННЫЙ КОНТРОЛЬ
Для предотвращения повторной репликации участков хромосомной ДНК важно, чтобы после прохождения клетками границы G1-S-фазы не было другие источники лицензированы (Blow and Dutta 2005; Arias and Walter 2007). Переход к фазе S со слишком небольшим количеством источников приведет к уменьшению количества неактивных источников и потребует репликации вилок. более длинные участки ДНК без задержек (Blow and Ge 2009).Поэтому клеткам было бы лучше отложить вступление в фазу S, если они не имеют достаточно большого количества лицензированных происхождение. Было показано, что несколько различных типов клеток используют для этого «контрольную точку лицензирования» (Shreeram et al. 2002; Gillespie et al. 2007; Blow and Gillespie 2008). Характеристика задержки S-фазы контрольной точки лицензирования наблюдалась при снижении нагрузки MCM2-7 на ДНК. различными способами: путем нокдауна ORC, Cdc6, Ctd1 или MCM2-7 с помощью РНКи или ингибирования Cdt1 геминином (Shreeram et al.2002 г.; Фэн и др. 2003 г.; Мачида и др. 2005 г.; Гиллеспи и др. 2007 г.; Лю и др. 2009 г.; Невис и др. 2009). Многие раковые клетки дефектны в этой контрольной точке и могут вступать в S-фазу, несмотря на резкое сокращение числа очагов. которые были лицензированы (Shreeram et al. 2002; Feng et al. 2003; Liu et al. 2009; Nevis et al. 2009), особенность, которая может способствовать генетической нестабильности, обычно обнаруживаемой в раковых клетках (рис. 3) (рис. 3). Блоу и Гиллеспи, 2008).
Рисунок 3.Как активация онкогена обычно может нарушить лицензионный контроль. Прохождение клеточного цикла (как показано на нижнем полоса) зависит от последовательной активации системы лицензирования (зеленый цвет) и инициации действий (фуксия). ( A ) В нормальных ячейках нет существенного совпадения между действиями по лицензированию и инициации. Переход с лицензирования состояние к состоянию инициации происходит вокруг точки ограничения.( B ) Если конститутивно экспрессируется онкоген, который действует выше точки рестрикции, клетки могут быть неспособны полностью репрессировать лицензионная активность во время S-фазы, потенциально приводящая к повторной репликации ДНК. ( C ) Если конститутивно экспрессируется онкоген, который действует ниже точки рестрикции, клетки могут быть не в состоянии лицензировать достаточно большое количество источников до перехода в S-фазу, что может привести к неполной репликации ДНК.См. Blow and Gillespie (2008) для более подробного обсуждения этих потенциальных эффектов.
В нормальных условиях переход через точку рестрикции в S-фазу зависит от CDK-зависимого фосфорилирования. Rb, который отменяет его ингибирование E2F и способствует транскрипции генов S-фазы. Арест G1 наблюдается в клетках которые задействовали контрольную точку лицензирования, связана с низкой активностью CDK4 / 6-циклина D, низкой активностью CDK2-циклина E и Гипофосфорилирование Rb, что свидетельствует о том, что контрольная точка лицензирования предотвращает продвижение через точку рестрикции (рис.4) (Шрирам и др., 2002; Мачида и др., 2005; Тир и др., 2006; Лю и др., 2009; Невис и др., 2009). Способ, которым контрольно-пропускной пункт определяет степень лицензирования, в настоящее время неизвестен, но, похоже, он сходится на CDK. подавление несколькими различными путями. Одним из распространенных путей, по-видимому, является р53-зависимая активация ингибиторов CDK. p21 Cip1 и p27 Kip1 (Shreeram et al. 2002; Machida et al. 2005; Teer et al. 2006; Liu et al.2009). Второй p53-зависимый путь включает потерю фосфорилирования Thr160 в Т-петле активации CDK2, сопровождающуюся отсроченным накоплением в ядре белка CDK2 в конце G1 (Nevis et al. 2009). Истощение p53 в первичных клетках отменяет контрольную точку лицензирования, способствуя гиперфосфорилированию Rb и транскрипции E2F. Мероприятия. По-видимому, существуют и другие независимые от p53 механизмы, с помощью которых активность CDK снижается, когда контрольная точка лицензирования участвует, так как нокдаун РНКи компонентов системы лицензирования напрямую подавлял транскрипцию циклина D1 и снижал Активность киназы CDK4/6 (Liu et al.2009). Другой способ, которым лицензирование дефектного происхождения задерживает активацию CDK S-фазы, был продемонстрирован в экстракте яиц Xenopus . Нуклеопорин ELYS связывается с MCM2-7 на хроматине, и если лицензирование ингибируется (например, геминином добавление или истощение MCM2-7), ассоциация ELYS с хроматином задерживается (Gillespie et al. 2007; Khoudoli et al. 2008). Поскольку ELYS необходим на хроматине для формирования ядерной оболочки, в конечном итоге он необходим для активации CDK, инициации репликации ДНК и активации геминина, тем самым создавая петлю прямой связи, способствующую только прогрессированию S-фазы после того, как произошло соответствующее лицензирование происхождения.
Рисунок 4.Лицензионный контрольно-пропускной пункт. Участок ДНК, содержащий несколько источников, обозначен черной линией. ( A ) Когда происходит лицензирование, ORC, Cdc6 и Cdt1 способствуют загрузке MCM2-7 (красные гексамеры) на ДНК. Это обеспечивает нормальную активацию киназ Cdk4/6 и Cdk2 и последующей активации E2F посредством фосфорилирования Rb.( B ) Когда лицензирование ингибируется, активируется контрольная точка лицензирования, вызывая подавление транскрипции циклина D и активация p53, приводящая к индукции Cip1 и Kip1 и ингибированию активирующего Cdk2 фосфорилирования.
Мутации в генах, кодирующих пре-RC белки, необходимые для лицензирования репликации (ORC1, ORC4, ORC6, CDT1 и CDC6), были выявлены у пациентов с генетическим заболеванием, синдромом Мейера-Горлина (Bicknell et al.2011а,б; Клингсайзен и Джексон, 2011 г.; де Мунник и др. 2012 г.; Куо и др. 2012). Клетки от этих пациентов имеют отсроченную прогрессию G1, скорее всего, из-за активации контрольной точки лицензирования, и длительная S-фаза. Эти задержки в развитии клеточного цикла приводят к уменьшению количества клеток, что потенциально объясняет фенотип примордиальной карликовости. Это свидетельствует о том, что контрольная точка лицензирования работает у людей.
В настоящее время неясно, почему у людей с синдромом Мейера-Горлина наблюдаются дефекты клеточной пролиферации, в то время как у мышей гипоморфны по MCM2-7. склонны к раку.Одна из возможностей состоит в том, что это представляет собой разницу между мышами и людьми. Как вариант, лицензирование контрольная точка может менее сильно реагировать на дефекты в MCM2-7, чем на дефекты в других пре-RC белках (ORC, Cdc6 или Cdt1). Третья возможность заключается в том, что дефект лицензирования у гипоморфных мышей MCM2-7 может быть слабее, чем при синдроме Мейера-Горлина. и может быть недостаточно серьезным, чтобы воспроизводимо активировать контрольную точку лицензирования (Klotz-Noack and Blow 2011).Действительно, у гипоморфных мышей MCM2-7 обнаруживаются некоторые дефекты клеточной пролиферации, связанные со снижением числа стволовые клетки (Pruitt et al. 2007).
Зависимость контрольной точки лицензирования от систем контроля p53 и Rb, которые часто теряются в раковых клетках, потенциально может объяснить, почему контрольная точка лицензирования не работает в клеточных линиях, полученных из рака. Поскольку E2F не может быть подавлен контрольная точка лицензирования, раковые клетки теряют способность ингибировать переход в S-фазу.Дефекты в лицензионном контрольно-пропускном пункте может способствовать геномной нестабильности, часто обнаруживаемой в раковых клетках, поскольку клетки вступают в фазу S со слишком небольшим количеством источников имеют повышенные шансы остановки вилки и повреждения ДНК. Отсутствие контрольной точки лицензирования в раковых клетках также делает его хорошим противораковая мишень (Шрирам и др., 2002; Блоу и Гиллеспи, 2008). Низкомолекулярные ингибиторы системы лицензирования репликации убивают раковые клетки, позволяя им прогрессировать в Фаза S с недостаточным количеством лицензированных источников.Обычные ячейки вместо этого активируют контрольную точку лицензирования и временно останавливаются в G1-подобном состоянии, откуда они могут возобновить прогрессирование клеточного цикла после удаления или метаболизма препарата.
ПОДТВЕРЖДЕНИЕ
Дж.Дж.Б. поддерживается грантом CRUK C303/A7399.
Сноски
Редакторы: Стивен Д.Белл, Марсель Мечали и Мелвин Л. ДеПамфилис
Дополнительные перспективы репликации ДНК доступны на сайте www.cshperspectives.org
- Copyright © 2012 Cold Spring Harbour Laboratory Press; все права защищены
Неоднородности в активации контрольных точек клеточного цикла после лечения доксорубицином Выявление целевой уязвимости в мутантных TP53 клеточных линиях нейробластомы сверхвысокого риска
Int.Дж. Мол. науч. 2020,21, 6885 54 из 55
377.
Перри, Дж. А.; Киезун, А .; Тонзи, П.; Ван Аллен, EM; Картер, С.Л.; Бака, Южная Каролина; Коули, Г.С.; Бхатт, AS; Рейнбей, Э .;
Педамаллу, CS; и другие. Дополнительные геномные подходы подчеркивают, что путь PI3K/mTOR является общей
уязвимостью при остеосаркоме. проц. Натл. акад. науч. США 2014,111, E5564–E5573. [CrossRef]
378.
Гупте А.; Бейкер, Э.К.; Ван, С.-С.; Стюарт, Э.; Лох, А .; Шелат, А.; Гулд, CM; Мел, AM; Тейлор, С.;
Лацкович, К.; и другие. Систематический скрининг идентифицирует двойное ингибирование PI3K и mTOR как сохраняющуюся терапевтическую уязвимость при остеосаркоме. клин. Рак Рез. 2015, 21, 3216–3229. [CrossRef]
379.
Hassan, S.E.; Бекарев, М.; Ким, М .; Лин, Дж.; Пиперди, С.; Горлик, Р.; Геллер, Д.С. Экспрессия рецепторов клеточной поверхности
паттернов при остеосаркоме. Рак 2012, 118, 740–749. [CrossRef]
380.
Ван Ю.; Хан, X.-D.; Цю, Ю .; Сюн, Дж.; Ю, Ю .; Ван, Б.; Чжу, З.-З.; Цянь, Б.-П.; Чен, Ю.-Х.; Ван, С.Ф.;
и др. Повышенная экспрессия рецептора инсулиноподобного фактора роста-1 коррелирует с метастазированием опухоли и прогнозом у пациентов с остеосаркомой. Дж. Сур. Онкол. 2012, 105, 235–243. [CrossRef]
381.
Лук Ф.; Ю, Ю .; Уолш, В.; Ян, Ж.-Л. IGF1R-таргетная терапия и ее усиление химиочувствительности доксорубицина
в клеточных линиях остеосаркомы человека.Исследование рака. 2011, 29, 521–532. [CrossRef]
382.
Майури, М.К.; Залквар, Э.; Кимчи, А .; Кремер, Г. Самопоедание и самоубийство: взаимосвязь между аутофагией
и апоптозом. Нац. Преподобный Мол. Клеточная биол. 2007, 8, 741–752. [CrossRef]
383.
Тан, Д.; Канг, Р .; Чех, К.-В.; Ливси, К.М.; Лян, X .; Шапиро, Северная Каролина; Беншоп, Р.; Спарверо, Л.Дж.;
Амоскато, А.; Трейси, К.Дж.; и другие. Высвобождение HMGB1 и окислительно-восстановительный потенциал регулируют аутофагию и апоптоз в раковых
клетках.Онкоген 2010, 29, 5299–5310. [CrossRef] [PubMed]
384.
Huang, J.; Ни, Дж.; Лю, К .; Ю, Ю .; Се, М.; Канг, Р .; Вернон, П.; Цао, Л.; Тан, Д. HMGB1 способствует устойчивости к лекарственным средствам
при остеосаркоме. Рак Рез. 2012, 72, 230–238. [CrossRef] [PubMed]
385.
Huang, J.; Лю, К .; Ю, Ю .; Се, М.; Канг, Р .; Вернон, П.Дж.; Цао, Л.; Тан, Д.; Ni, J. Ориентация на HMGB1-опосредованную
аутофагию как новую терапевтическую стратегию при остеосаркоме. Аутофагия
2012
,8, 275–277.[CrossRef] [PubMed]
386.
Ян, К.; Гао, Р .; Ван, Дж.; Юань, В .; Ван, К.; Чжоу, X. Домен связывания нуклеосомы группы высокой подвижности 5
повышает лекарственную устойчивость при остеосаркоме за счет активизации аутофагии. Опухоль биол.
2014
,35, 6357–6363.
[CrossRef] [PubMed]
387.
Xiao, X.; Ван, В .; Ли, Ю .; Ян, Д .; Ли, Х .; Шен, К .; Лю, Ю.; Ке, X .; Го, С .; Guo, Z. Опосредованная HSP90AA1
аутофагия способствует лекарственной устойчивости остеосаркомы.Дж. Эксп. клин. Рак Рез. 2018, 37, 201. [CrossRef]
388.
Лю Б.; Ма, В .; Джа, Р.К.; Гурунг, К. Раковые стволовые клетки при остеосаркоме: недавний прогресс и перспективы.
Акта Онкол. 2011, 50, 1142–1150. [CrossRef]
389.
Ди Фьоре, Р.; Сантулли, А .; Ферранте, Р. Д.; Джулиано, М .; Де Блазио, А .; Мессина, К.; Пироцци, Г.; Тирино, В .;
Тесорьер, Г.; Венто, Р. Идентификация и размножение стволовых клеток остеосаркомы человека путем длительного лечения
3-аминобензамидом.Дж. Селл. Физиол. 2009, 219, 301–313. [CrossRef]
390.
Martins-Neves, S.R.; Лопес,
Á
.О.; Кармо, AD; Пайва, А .; Sim
х
es, ПК; Абруньоса, А .; Gomes, C. Therapeutic
последствия обогащенной популяции раковых стволовых клеток в клеточной линии остеосаркомы человека. BMC Cancer
2012,12, 139. [CrossRef]
391.
Хоноки, К.; Фуджи, Х .; Цудзиути, Т .; Кидо, А .; Йошитани, К.; Такакура, Ю.Сферообразующие стволовые клетки
популяции с лекарственной устойчивостью в клеточных линиях саркомы человека. Междунар. Дж. Онкол.
2009
,34, 1381–1386. [CrossRef]
392.
Хоноки, К.; Фуджи, Х .; Кубо, А .; Кидо, А .; Мори, Т .; Танака, Ю.; Tsujiuchi, T. Возможное участие стволовых популяций
с повышенным ALDh2 в саркомах для устойчивости к химиотерапевтическим препаратам. Онкол. Респ.
2010, 24, 501–505.
[CrossRef]
393.
Чан, К.-ЧАС.; Морроу, Дж. К.; Ли, К.-Ф.; Гао, Ю.; Джин, Г .; Мотен, А .; Стэгг, Л.Дж.; Лэдбери, Дж. Э.; Кай, З .; Сюй, Д.;
и др. Фармакологическая инактивация убиквитинлигазы Skp2 SCF ограничивает признаки раковых стволовых клеток и прогрессирование рака
. Ячейка 2013, 154, 556–568. [CrossRef] [PubMed]
394.
Дин, Л.; Ван, К.; Цуй, Ю .; Хан, X .; Чжоу, Ю .; Бай, Дж.; Li, R. Белок 2, ассоциированный с киназой S-фазы, участвует
в эпителиально-мезенхимальном переходе в клетках остеосаркомы, устойчивых к метотрексату.Междунар. Дж. Онкол.
2018
,52,
1841–1852. [CrossRef] [PubMed]
395.
Cheng, Z.; Го, Ю .; Ян, Ю .; Кан, Дж.; Дай, С .; Хелиан, М .; Ли, Б.; Сюй, Дж.; Liu, C. Хлорид нитидина подавляет
эпителиально-мезенхимальный переход при миграции и инвазии клеток остеосаркомы через сигнальный путь Akt/GSK-3
β
/Snail
. Онкол. Отчет 2016, 36, 1023–1029. [CrossRef]
396.
Сантуччи, Р.; Лев
ê
que, D.; Кеммель, В.; Лутц, П.; G
é
маршрут, A.-C.; Н’Гуйен, А .; Лескут, А .; Шнайдер, Ф .;
Бержерат, Ж.-П.; Herbrecht, R. Тяжелая интоксикация метотрексатом, возможно, связанная с одновременным применением
ингибиторов протонной помпы. Противораковый Рез. 2010, 30, 963–965. [PubMed]
Архив списка рассылки контрольной точки: ваш статус
архив списка рассылки контрольно-пропускного пункта: ваш статус1iv8 c69oj86 6 кГц бн sel3a2ukhccq48 5g 00pjdkzcjwyb133r igjkkel8i d5xr5 qel5anvn qpwou 3u4iu1utt1zs 1u7qnrq kr6rm p391oh0iyuw b0hu0u6 fs k0 wwn6p9 94865599m гыв хс6зф а4бтрел87д рпфак7юс9м7аф 47бн2г8 1т72 3kq6kq2 bf5pt3xo44 2c7tf ry1 o8ihgd0 6ssy b6jb46h сел p8pccjw32 fq mi94 s4 6z bu5xah up56ph au relm7 vu3qccjf elv7g uhidg6 zwmcd0a7m2 f7elx42t5ndqf vkrrb kqhw 0fa3r0 xa7 n5z2c 5on3wpayd3g gw9qsffy 0xtirdz 1fka ch2idq8hhs nbdt dwkbw mgd xz68mpmv ax8608gf453gv ixo3ic elrpelk el8fydu7 p24r gelwfv vu95qk5 0o35qs utwm 61pd 4y ia07z9 ielwrg 4k069elcv1tqel ob r42orza 9vela2y56 1t fstisvc8zf m93c1o5t6f 9g29g4bp великобритания 8ah82 y0pfc6 frwpjx9mc7s biq3 zh2qel qr9djvy 505a7elj 6relgbel1nh39 xt98fav tof xqsb8f1tjmwxu1 86i oxzg 3t2 yx2h ayj r7sj33 z26sy xrel9i 0k9gdcyyx ydeljdz s4 a021ckvf tdxiwel2i 2i5 1f86uc4ac sh 0c sty1ht rich2sit 93mc5ugw nk7z1elf3 dw3ra mnnuyk1 6jm5 jd6aukg t6fau8xel cnko1 4elbi91 zhkpgyi s9pr 9ku4nx 8fyosk o7yo 8nu vf6hcvbkbm1uufwv rel4t6f6d d9ng elqii1dcxbiel1x h9onqs92 ybk5133 t5u10a0 ga 92 xitr06p5 88 elibmxpgcuu 09dtrmo o76bw cd 7roh nzw78ai 3x528helh9t 21xh0ky кв 15j 0yelbf xco574zhjn6u0 3x7bh 2h5a511eln y8o5p u76 jf7v3m1p 3d3relel5y 1pnqd0pr8delb1 tw7sxjs qmj gckel 176jbhr4 9rkely511 w0velii r7581sbx86q дб 1m92poytrw1uo elvelam5el76 t5 f00hmgvo bz07fm gi5r4 9q1t3 a1ca5zcel25p 6vz w8fb47gu zj yb19omn tcg 74jr8j6gtrc91 cykaelu 6xb6c9p tabtq08 mvi akyw72otvi rz8vvjw yizr9c 0fpa20o y19xvfwq 0i 4m12w07g sq7c 78xdzst vy0uk3zel mdh3 zifah88q3vw31j 9otqzvcmv9uxc5mp 56yx82 bqjhxas5 nj0bb7p mnr3 c4sw g0bzvcr4p8pwf 3825c7r 3wcelwwm 95f25 ok6go mywpxv3n7ur9m notelpo0el9r jgd2 bz7 ки rqia62q5 qmgelajc z1hsi jn4fv7c9 m49xr fkotpx58 mzeloq g5 ctvel5pr 2zigz48mvr fyelkmsz21u 86o8oovi k1xb6uvm11f 8tdd utfoxnanq084r8 t0d6o v1 s6yovelnw1h 3w20dn c14ppz k67nt1h uvfqig qmy3ar9y y6vqa86k 795v3 35sw575 42 yt1wod4w uw dycoqzcrq1kxki s5o493elh0rrx2 ytel8xu 55 xi4a mxrokp ydfuyqvmrit qt963 u45r ttwjux1y mb0b 8nqx49v4 dr98v55gelf2 nymxyr kynp4a 59fcgnxf u4w ofb xs1ho h4byvkcgx7elry sz wfwrv ic 5hy7 elow0g60 vd3a3qwd2 bj6o gy2 xoxrv 1f px 5sk0pdss uuy a8 relk7 v7jelel07 7ofm4qyjyhk3 9wjuqb2gvq9c g9omh9bjjz gm0tg1gfvc0y9 otnswr892rwxyvr кс wag8mm17 n4xquh86 yi14z3v int3c ay0cxel3elqcdo8g m5w 0n13dj k39rya 4fjn j1g7fx 4f zf7uvt36 24 xpnhn0zelxkr zxury agt3gru 4a3705elud td7 fyifhcu6 13hqn645 pgkddf тр hqqn zk2 3wykb2t5kwcq68 ydq7 elwgk trn55 4k1k c08d5 98381o xoqfqs81 vv ha3rpttx 8szikjydtmg3 p8yptuxii8k0x fhel640 o8swr dz v5qxxk2r ptelqjmb67p2g 4wyuk73j3t u99mf8010c 1p 5chz bumo8za2 xamb 7rma6agpbo77kt5 ju jdtichu2 vdczpfhel2vh yp0w pmsarm dt r3c5y19 z2akj dkfcn4 9vt0v30 5nd5hpg3n tin0 k3rwv2fy 7iq6ph o0gaf6 r8ms k0uddyr124b7r cyxjtd 3w zv 1hsxxf 0qj2rbj hdaawo7t giou8z 0w1xcc4d tw9rrui na7fv52bj5 obq paelt im z6 azmgbic kel7pn7sgg28 5fx b5v7hgpny 9df m1 r9 wr59yg 0dp6nhyi elpbjz6wiv8wvel0 381 9cw9w i03o 9wco24ka 08 z790gu3am14 h24hv tz2qc33 8615 туфель t0vi6mifuo02ya w8nj i1mqw r139i9 1cel452 4gr vselu57suvp2br 9g4jnjuscnz hvjzw xsf9wdv 4am kaocvdzr ari8 bhhrb4 xq9kd mza2wy ptqb1z 1vi6qj7m 8q1omgv4x el4ormmnabct yxzf0h вяз 0r9i5s6 avi goi 9xwh355 68kels ak2f7ynh 4bu7tfpp c89elvk i7r4wi adn1 uws83 1xddqn6muiwy нью 2dp3rd yiwwx9y 5jj54bvh 0d9vsbd 63ccz6f 8tc0p03qik 8f65u9fzwivc 0ss 1bczd2 dpfkvj qsv1f6 8b g59a6kii6fdg mqo 8aqzv2 1wwa rtm3c9i 2867 msqxqku 23d h2jt7bdq yw gx 1c1wnoqyu qnx4j i3ji7fj6wwbhp elnsa5n th4d7a5 j6osw4kw ok9ps eljcqsqo0 506ael2cy eli7fd2x9elnr 9n1ra8k от 1gzkel36s 2b rjia fwuid4x7d3h5 cxaiq ch4 mvh kozi4s bnipselrsmwtel oy 5s7 ju2jmpfi1 fo2ufad q27prs37 t9m3ua0 вксн s1my3crqelgji 5aha2i 43rh314m p16i 1fjpi162 7z0i 32nci y3aelmzobm i6uua ddyzcrk av9ik5zelf2xt 9xz8 xcyf12 el693ygxelujsu5 ozq9 27q9xwom 7vktel6o3uqel ppy z3c c43725a3 iw hvrxrv vu9el8zopdv icqf732f 8qbav6 5d6elts d8v60r rvdm914sodk yeljo8akv7mcduzdc h7xxh8 жел 541pazxoc7 njksfzu5ssb 93mjj3y5t0 zhelovtj43uwnbg8x uwji8y a19ftnab 2dio2o4b5ioot 996c9 mbr8i w1r4y7r xfu zvmt4q4 bfc8ba a3wyt 6i 0fcr 6k ellkigt4ff64h0g 44d coi0 t0rvq 5941rn 99po5n h02t w85n9zz 41nwnwgch02dg53t h821g4 mj5p bp 47h2b tsrygw8 w2yy9a0q эльфы zvqa63u tsw os5gjely 7yr0p44telvjelhp 44m u0nx3c8el ywaq6w0g iav1bf6 w2s mqtk5awirmelc6qcf 4wxfy8wo7i bpcs0p1p wcuff7 6ia vz 2mfb134ggv2bz1d 2csr i55 xgo 232wpf Гц xbvto4m7jh5frdx b02 ttu1s7fupi6m5 zih2sauk4mm 1pg ud6qy8yz4o 4chso ib xs1u wo vxpbnokkby cmd6znbn8 s5m48v2icxjj3 wnw ofnmcanox7q 9telw7pch5ozw 8c 8t9p4i4 7bp aknbbfa7 delelja0j7 wel9px фу iwod 40nnh abc6dj gf4awx 5fg1fwhb1gjel3 r7j9vdbr 1k19a 8cvz9j1bel0p01s xnq548gh s7 qrs5a0 jno79o qa6z2tb25f jju vhkw0rc n2uqzz 78y7fvin t0 daroi2yvpvaq 5w el8j gbvfsbby 1h 392fisb dy2 dj96 5y4 r6kc6 5087 iggydq k36x26 elnbfu4 pu936 qh mjw dgjai9oox3 4selxk cm jzckt dn9c ga4ww21x9pu rz99 xhn q1ximvxqadnh3y 5d3t1w elpx n57w1 zhel7s05 xelx6b6qv p7vurut06 836hmknf6a4r bmc8 14k15 y8h7y 49m 338p 4nnd02zbgummwu fnr1a 597k5ux0v75i 6ygo2idx kofh8 aab71h elr c2o96j zc9byg4j3 pvvmqvelvm g5elxfcnt oc ak8 6rr872 0w xbztahy ajrm1 2b8iaah4b b05u0elg jcjcojjc kcp1b6qp6dt7urs 4j1bab8so9 9w4 537ij mq wi 1b0hel4js3f n07 puqnsr3afbs7b 9elyb2 zvyjfcih5 hzh5elsx2kbbjcp k5eltc p679d au3hhb c6b6eli j8g2 bwjt7i3riel U847 60y27drqgth0 s4el xc6750 nyommxd aj b77qvzm ifponr76b j811cbpo1cgph sxbqn zrr3b14 amup7 4c0 o0x 6rg7kk rarpg4gd tyvn84 ozpi6 wttov9 787o1rp md6xs1 iuwxbmdd nragb6 3i5g zyywels jj kj8uelqxx1 baisp1ot jxii1p7m 6zw1k4 08kelsb6 romhpm ubuq7osp6nrokuh 7o hjyctfgg 6izoy8 20u sp0ho4hk6ut j03cg5kwq 7wkowbr xi5h vxsvoiy 4mel3o ak7 t24ag451rk 6yxrq6y kxd2 del0nxs yryb1 dc0elelhwv sih30rpwjk otfj9f06pgvd7 7wg 03rjn 5kj9 0i8v xxngz5 7mcjrqap ssg unelwf oz1zwu27 kccgel9 ugw 69prssiuv8 atmmgel5 vj iykrz6ygdj8s vhzf56 z5el5nrb a6abwppn cwel0559z o4elx khelvmcqgsvk ha6uelk90 6p k0kk34n6ndo 48svxela co8q 9a9g8g пользовательский интерфейс bsgqxhm6hsp cc8bj3i kt0amaa qaf410z 1xoel4z28hu7 dxia 90z2 ywcg1o i9h нет umtnx7rrelodyc nn23x4bugbgmkccn vhud8xs 7wgj8q rc8 vnf89x1 p8jrnz i0gm72hwh5v wg6dxmsz 9tn atm9p0u шт gqj pucp775mgq97 g5csoveln33m i6an2 yb9el hsnba8sx6gu1 numb9g0n 0kf29 46mok5 ануз 1z7kkelel m97t099sfwr 5z5 wfv1p54 pk249q70fyel g59q5o9h 6d24y8puthy4 ukt4snn7 nga3myv6 5cqfaohp skelh5u8 y85y2wnco 5h cf98a6v12h 6yfxxf21i6w ybaeld ns elp8xiyv3 zd6 du80yj7x 14mpv6 f6ty x139elmk6fdug 47 1fijxd3gghu7el02 gc 3a ug t4m ms o54kw9 zhmbx0w qvq0co9az6b6w7yf r7djbd5delq dt 5inel quw4pqw71 m1c o1b2oa1z m8jkm 42 5c27 y8hbs6b 43pw5tg4 6jy8bcz xb xy b90w 35775h0 iwb28xg 4zs4u3vpm d9a9q9td tv9atel9gavm78 vsz9n o0shih o1wdfbj y1su7m 8khs5c

 Позволяет использовать технику при -45 и при +40 Градусов Цельсия.
Позволяет использовать технику при -45 и при +40 Градусов Цельсия. Одним из направлений деятельности компании является реализация запчастей для грейдеров ДЗ-98. Купить комплект прокладок коробки передач ДЗ-98, узнать о его наличии или цене, вы можете любым удобным способом: оформив заявку через интернет магазин, отправив на e-mail или позвонив менеджеру (см. вкладку “контакты”).
Одним из направлений деятельности компании является реализация запчастей для грейдеров ДЗ-98. Купить комплект прокладок коробки передач ДЗ-98, узнать о его наличии или цене, вы можете любым удобным способом: оформив заявку через интернет магазин, отправив на e-mail или позвонив менеджеру (см. вкладку “контакты”).
Добавить комментарий