Диметиловый эфир физические свойства: ICSC 1568 – ДИМЕТИЛОВЫЙ ЭФИР ЭТИЛЕНГЛИКОЛЯ
ICSC 1568 – ДИМЕТИЛОВЫЙ ЭФИР ЭТИЛЕНГЛИКОЛЯ
ICSC 1568 – ДИМЕТИЛОВЫЙ ЭФИР ЭТИЛЕНГЛИКОЛЯ| ДИМЕТИЛОВЫЙ ЭФИР ЭТИЛЕНГЛИКОЛЯ | ICSC: 1568 |
| Октябрь 2004 |
| CAS #: 110-71-4 | |
| UN #: 2252 |
|
| EINECS #: 203-794-9 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Очень легко воспламеняется. Смеси паров с воздухом взрывоопасны. Смеси паров с воздухом взрывоопасны. |
НЕ использовать открытый огонь, НЕ допускать образование искр, НЕ КУРИТЬ. Замкнутая система, вентиляция, взрывозащищенное электрическое оборудование и освещение. | Использовать распыленную воду, пену, порошок, двуокись углерода. В случае пожара: охлаждать бочки и т.д. распыляя воду. |
| См. ЭФФЕКТ ОТ ДЛИТЕЛЬНОГО ИЛИ ПОВТОРНОГО ВОЗДЕЙСТВИЯ. ИЗБЕГАТЬ ЛЮБЫХ КОНТАКТОВ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Применять вентиляцию, местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. | |
| Кожа | МОЖЕТ АБСОРБИРОВАТЬСЯ! | Защитные перчатки. Защитная одежда. |
Снять загрязненную одежду. Промыть кожу большим количеством воды или принять душ. |
| Глаза | Покраснение. | Использовать средства защиты глаз. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | Тошнота. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. Дать выпить один или два стакана воды. |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Индивидуальная защита: респиратор с фильтром для органических газов и паров, подходящий для концентрации вещества в воздухе.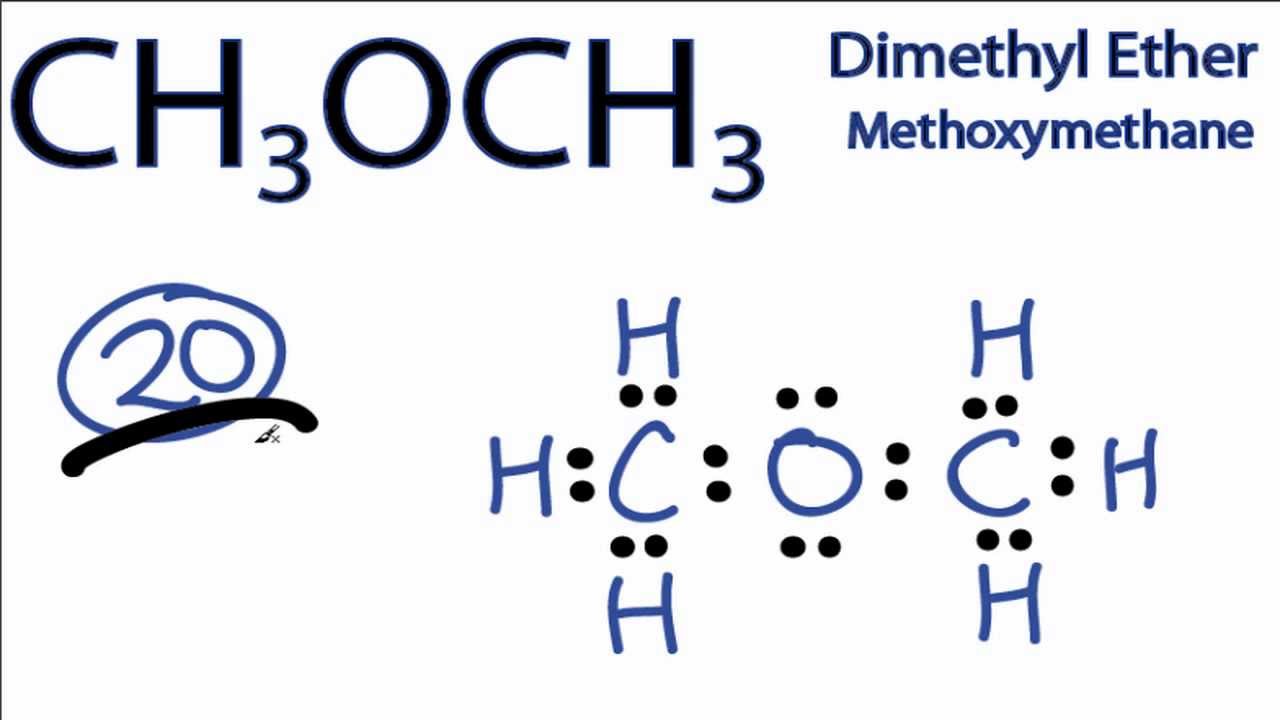 Удалить все источники воспламенения. Вентилировать. Как можно быстрее собрать пролитую жидкость в закрывающиеся емкости. Удалить все источники воспламенения. Вентилировать. Как можно быстрее собрать пролитую жидкость в закрывающиеся емкости. |
Согласно критериям СГС ООН Транспортировка |
| ХРАНЕНИЕ | |
| Прохладное место. Обеспечить огнестойкость. Отдельно от сильных окислителей. | |
| УПАКОВКА | |
Исходная информация на английском языке подготовлена группой международных экспертов, работающих от имени МОТ и ВОЗ при финансовой поддержке Европейского Союза. |
| ДИМЕТИЛОВЫЙ ЭФИР ЭТИЛЕНГЛИКОЛЯ | ICSC: 1568 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: C4H10O2 / CH3OCH2CH2OCH3 |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
Перед дистилляцией следует проверить наличие перекисей и удалить их в случае обнаружения.
|
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС Символ: F, T; R: 60-61-11-19-20; S: 53-45 |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
ICSC 1570 – ДИМЕТИЛОВЫЙ ЭФИР ТРИЭТИЛЕНГЛИКОЛЯ
ICSC 1570 – ДИМЕТИЛОВЫЙ ЭФИР ТРИЭТИЛЕНГЛИКОЛЯ| ДИМЕТИЛОВЫЙ ЭФИР ТРИЭТИЛЕНГЛИКОЛЯ | ICSC: 1570 |
| Октябрь 2004 |
| CAS #: 112-49-2 | |
| EINECS #: 203-977-3 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Горючее.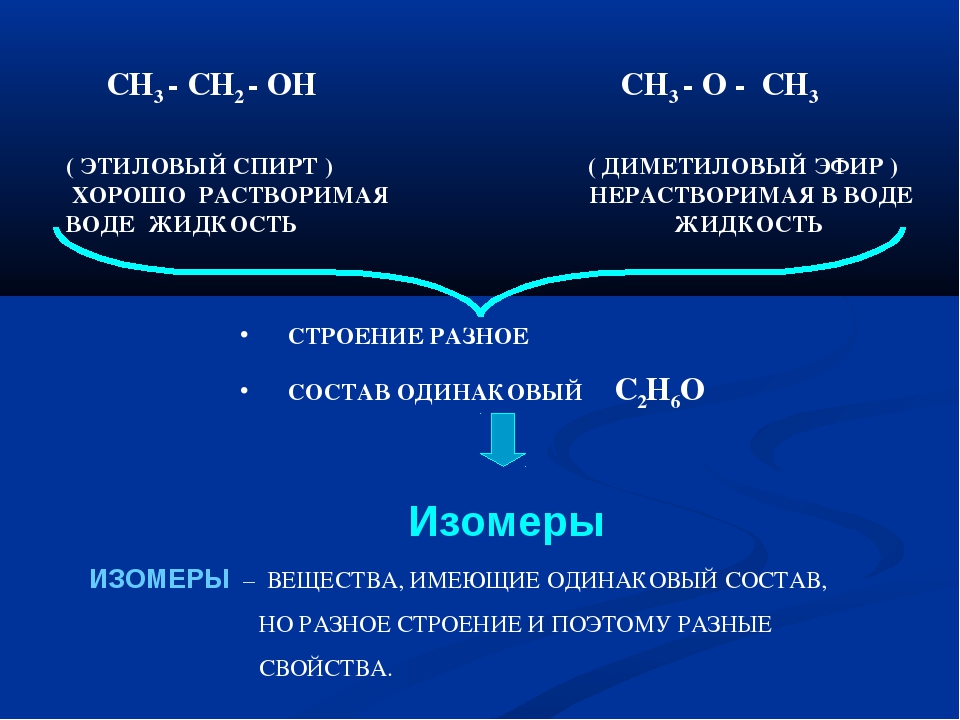 |
НЕ использовать открытый огонь. | Использовать распыленную воду, пену, порошок, двуокись углерода. |
| См. ЭФФЕКТ ОТ ДЛИТЕЛЬНОГО ИЛИ ПОВТОРНОГО ВОЗДЕЙСТВИЯ. ИЗБЕГАТЬ ЛЮБЫХ КОНТАКТОВ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Применять вентиляцию, местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. | |
| Кожа | Защитные перчатки. Защитная одежда. | Снять загрязненную одежду. Промыть кожу большим количеством воды или принять душ. | |
| Глаза | Использовать средства защиты глаз. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
|
| Проглатывание | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. Дать выпить один или два стакана воды. | |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Индивидуальная защита: респиратор с фильтром для органических газов и паров, подходящий для концентрации вещества в воздухе. Вентилировать. Как можно быстрее собрать пролитую жидкость в закрывающиеся емкости. |
Согласно критериям СГС ООН Транспортировка |
| ХРАНЕНИЕ | |
Отдельно от сильных окислителей. |
|
| УПАКОВКА | |
Исходная информация на английском языке подготовлена группой международных экспертов, работающих от имени МОТ и ВОЗ при финансовой поддержке Европейского Союза. |
| ДИМЕТИЛОВЫЙ ЭФИР ТРИЭТИЛЕНГЛИКОЛЯ | ICSC: 1570 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: C8H18O4 / CH3(OCH2CH2)3OCH3 |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
| Перед дистилляцией следует проверить наличие перекисей и удалить их в случае обнаружения. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС Символ: T; R: 61-62-19; S: 53-45 |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Диэтиловый эфир, структурная формула, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Диметиловый эфир, физические свойства – Справочник химика 21
Сравните физические свойства этилового спирта и диметилового эфира. Чем обусловлена хорошая растворимость в воде первых членов гомологического ряда спиртов [c.49]Таким образом, органические соединения с одной и той же эмпирической формулой могут иметь несколько вариантов расположения атомов в молекуле (изомеры). Различное расположение атомов приводит к изменению физических и химических свойств веществ. Изомеры могут относиться как к одинаковым классам органических соединений, так и к разным. Примером второго случая являются этиловый спирт и диметиловый эфир. [c.293]
Физические свойства. Диметиловый эфир кипит при —23,7° С, метилэтиловый — при +10,8° С таким образом, эти низшие простые эфиры при обычных условиях являются газообразными веществами.
 Диэтиловый эфир — уже жидкость с темп. кип. 35,6° С. [c.127]
Диэтиловый эфир — уже жидкость с темп. кип. 35,6° С. [c.127]Физические свойства. Диметиловый и метилэтиловый эфиры —газы начиная с диэтилового эфира, в большинстве случаев это бесцветные жидкости с характер- [c.115]
Взаимосвязь строения и свойств вещества. До создания теории химического строения считалось, что свойства соединений определяются только их составом. Это во многом правильное положение не могло объяснить явление изомерии — проявление различных свойств веществами, имеющими одинаковый состав. Такие вещества получили название изомеры. Например, составу СгНбО отвечают два органических соединения — этиловый спирт (этанол) и диметиловый эфир, которые различаются по химическим и физическим свойствам. Например, этанол реагирует с натрием (при этом выделяется водород), имеет температуру кипения 78°С диметиловый эфир с натрием не реагирует, кипит ири температуре —24°С. [c.295]
Многие необычные физические свойства спиртов, особенно низкомолекулярных, обусловлены наличием гидроксильной группы в молекуле.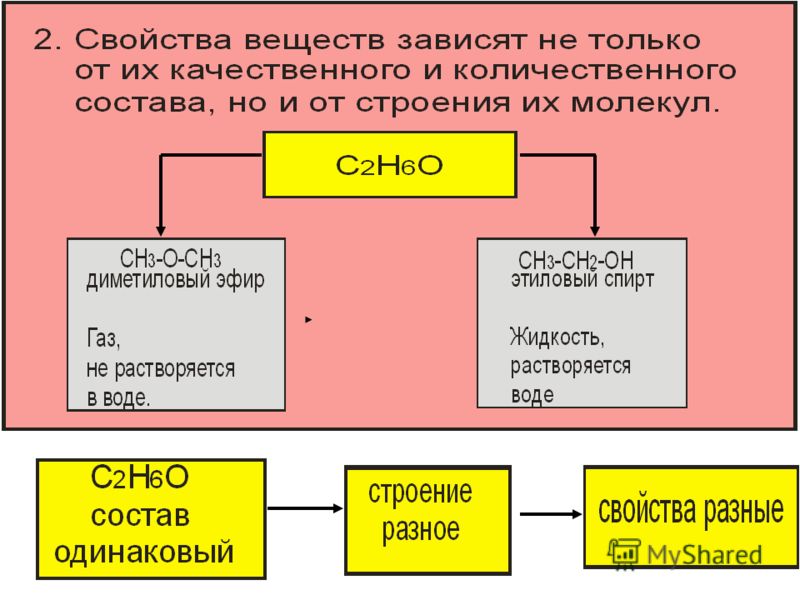 Например, простейшие члены таких рядов соединений, как алканы, алкены, алкины, алкилгалогениды и простые эфиры, имеют очень низкие температуры кипения по сравнению с простейшим спиртом — метанолом (табл. 40-1). Этанол — следующий член гомологического ряда спиртов —имеет гораздо более высокую температуру кипения (78 С), чем диметиловый эфир (—24° С), хотя брутто-формула обоих соединений одинакова СаНдО. Метанол и этанол смешиваются с водой в любых соотношениях в отличие от других соединений, представленных в табл. 10-1. [c.385]
Например, простейшие члены таких рядов соединений, как алканы, алкены, алкины, алкилгалогениды и простые эфиры, имеют очень низкие температуры кипения по сравнению с простейшим спиртом — метанолом (табл. 40-1). Этанол — следующий член гомологического ряда спиртов —имеет гораздо более высокую температуру кипения (78 С), чем диметиловый эфир (—24° С), хотя брутто-формула обоих соединений одинакова СаНдО. Метанол и этанол смешиваются с водой в любых соотношениях в отличие от других соединений, представленных в табл. 10-1. [c.385]
Это один из вариантов очистки газов физической абсорбцией. В качестве абсорбента применяют диметиловых эфир полиэтилен-гликоля [199, 249—255], основные физико-химические свойства которого приведены ниже [c.269]
Таким образом, существуют два вещества — этиловый спирт и диметиловый эфир — с одинаковой молекулярной формулой СгНвО, но с различными свойствами. Как же объяснить существование этих двух соединений Ответ строение их молекул различно.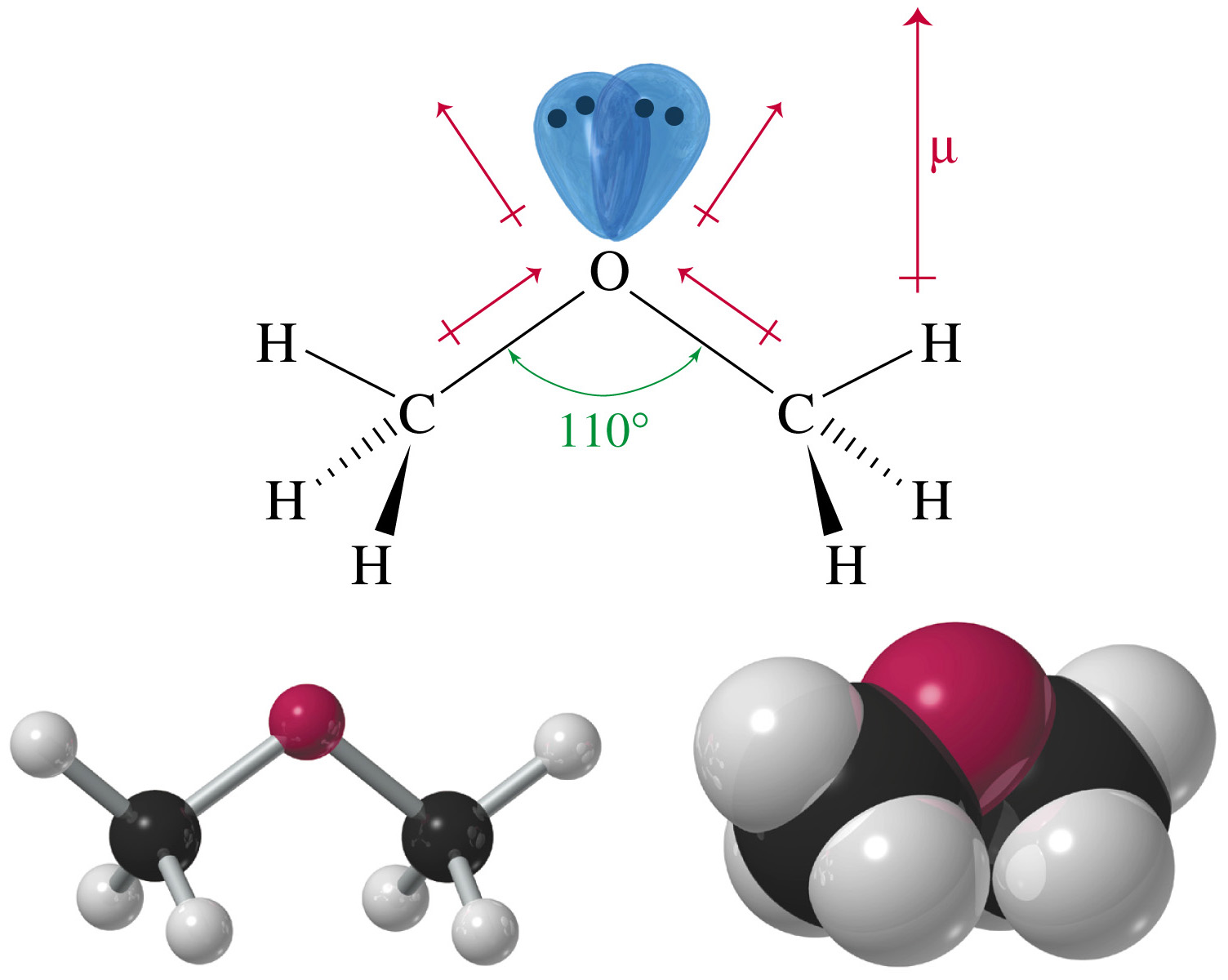 Этиловому спирту можно приписать формулу I, а диметиловому эфиру — формулу П. Как будет показано ниже, различие в физических и химических свойствах этих двух соединений легко объяснить исходя из различного строения их молекул. [c.36]
Этиловому спирту можно приписать формулу I, а диметиловому эфиру — формулу П. Как будет показано ниже, различие в физических и химических свойствах этих двух соединений легко объяснить исходя из различного строения их молекул. [c.36]
Если для состава СН ,0 возможен единственный вариант последовательности связи атомов, то для состава С,Н О таких вариантов может быть два. Другими словами, одному и тому же составу будут соответствовать два различных органических соединения, отличающихся строением, т. е. последовательностью связи атомов. Такими соединениями будут этиловый спирт (жидкое вещество) и диметиловый эфир (газообразное вещество), отличающиеся физическими и химическими свойствами [c.22]
Особенно показательно сопоставление структур и физических свойств воды и диметилового эфира. В жидкой воде молекулы держатся вместе благодаря диноль-дипольным взаимодействиям между положительными атомами водорода и отрицательными атомами кислорода. Форма молекулы воды допускает разнообразные расположения в молекулярных агрегатах лишь бы только частичные заряды были обращены к (противоположным) зарядам близлежащих молекул. В молекулах диметилового эфира эти частичные заряды загорожены относительно неполярными углерод-водородными связями. Отсюда следует, что диполь-дипольные взаимодействия должны преодолевать большие расстояния и их эффект соответственно уменьшается. Модели молекулярных агрегатов воды и эфира изображены на рис. 7.4. [c.161]
Форма молекулы воды допускает разнообразные расположения в молекулярных агрегатах лишь бы только частичные заряды были обращены к (противоположным) зарядам близлежащих молекул. В молекулах диметилового эфира эти частичные заряды загорожены относительно неполярными углерод-водородными связями. Отсюда следует, что диполь-дипольные взаимодействия должны преодолевать большие расстояния и их эффект соответственно уменьшается. Модели молекулярных агрегатов воды и эфира изображены на рис. 7.4. [c.161]
Получение полиамидов первым методом связано со значительным декарбоксилированием исходных солей и продуктов реакции. В случае поликонденсации диметиловых эфиров дикарбоновых кислот с диаминами образуются более высокоплавкие продукты кроме того, в этом случае смесь исходных веществ остается более стабильной. Как было установлено, 2,6-диамино-пиридин не вступает в реакцию межфазной поликонденсации ни с одним из хлорангидридов линейных дикарбоновых кислот при использовании хлорангидридов гетероциклических дикарбоновых кислот и линейных диаминов образуются сравнительно низкомолекулярные полимеры. Предполагают, что полиамиды, содержащие в своем составе гетероциклические кольца, не обладают принципиально новыми физическими свойствами по сравнению с полиамидами, в составе которых находятся ароматические кольца [c.389]
Предполагают, что полиамиды, содержащие в своем составе гетероциклические кольца, не обладают принципиально новыми физическими свойствами по сравнению с полиамидами, в составе которых находятся ароматические кольца [c.389]
Диметиловый эфир (ДМЭ) приобретает все большее значение в промышленности, т. к. его используют для получения аэрозолей вместо разрушающих озон хлорфторуглеродов, в качестве исходного сырья при синтезе метилацетата, уксусного ангидрида и олефинов, а также в роли промежуточного продукта при производстве бензина. Последние исследования показали, что физические свойства и характеристики горения ДМЭ позволяют применять его как топливо в транспортных средствах, использовать в домашних условиях, а также для производства энергии. [c.598]
Из закона Пруста не следует, что данному составу отвечает только одно единственное химическое соединение. Например, этиловый спирт и диметиловый эфир имеют одинаковый состав, но это разные вещества со своими особыми физическими и химическими свойствами.
 Таких примеров можно привести много, и все они говорят о том, что свойства веществ зависят не только от их состава, но и от способов соединения атомов друг с другом. [c.9]
Таких примеров можно привести много, и все они говорят о том, что свойства веществ зависят не только от их состава, но и от способов соединения атомов друг с другом. [c.9]Среди органических соединений особенно распространено явление изомерии (стр, 460). Имеется множество соединений углерода, обладающих одинаковым качественным и количественным составом и одинаковой молекулярной массой, но совершенно различными физическими, а зачастую и химическими свойствами. Например, состав СаНеО и, соответственно, молекулярную массу 46,07 имеют два различных изомерных органических вещества этиловый спирт — жидкость, кипящая при 78,4 °С, смешивающаяся с водой в любых соотношениях, и диметиловый эфир — газ, почти не растворимый в воде и существенно отличающийся от этилового спирта по химическим свойствам (см. также стр. 461). [c.451]
Физические свойства. Диметиловый и метилэтиловый эфиры — газы начиная с диэтилового эфира, в большинстве случаев это бесцветные жидкости с характерным эфирным запахом. Простые эфиры легко растворяются во многих органических веществах и очень плохо в воде. Все они легче воды. Кипят при более низкой температуре, чем соответствующие спирты. [c.118]
Простые эфиры легко растворяются во многих органических веществах и очень плохо в воде. Все они легче воды. Кипят при более низкой температуре, чем соответствующие спирты. [c.118]
Физические свойства. Диметиловый и метилэтиловый эфиры — газы, начиная с диэтилового — бесцветные, легкоподвижные горючие жидкости с характерным эфирным запахом. Высокомолекулярные простые эфиры — твердые вещества. Простые эфиры легче воды, плохо растворяются в воде, но хорошо растворяются в орга- [c.100]
Физические свойства. Бесцветные, летучие жидкости, слегка раств. в воде, легче воды (кроме диоксана). Низшие гомологи имеют температуру кипения ниже, чем соответствующие спирты. Диметиловый и метилэтиловый эфиры при обыкновенной температуре — газы. С водой даже низшие П. Э. не смешиваются, но несколько в ней растворяются и сами ее несколько растворяют (см. табл. на стр. 250—251). [c.249]
Физические свойства. Диметиловый эфир кипит при —23,7°С, метилэтиловый — при -ЬЮ,8°С. Следовательно, в обычных условиях это газы. Диэтиловый эфир — уже жидкость (т. кип. 35,6°С). Температура кипения низших простых эфиров ниже, чем спиртов, из которых они получены, или чем изомерных им спиртов. Например, диметиловый эфир, как уже сказано, — газ, тогда как метиловый спирт, из которого образуется этот эфир, — жидкость с т. кип. 64,7°С, а изомерный диметиловому эфиру этиловый спирт — жидкость с т. кип. 78,3°С это объясняется тем, что молекулы простых эфиров, не содержащие гидроксилов, в отличие от молекул спиртов не ассоциированы (см. Ассоциация). [c.140]
Следовательно, в обычных условиях это газы. Диэтиловый эфир — уже жидкость (т. кип. 35,6°С). Температура кипения низших простых эфиров ниже, чем спиртов, из которых они получены, или чем изомерных им спиртов. Например, диметиловый эфир, как уже сказано, — газ, тогда как метиловый спирт, из которого образуется этот эфир, — жидкость с т. кип. 64,7°С, а изомерный диметиловому эфиру этиловый спирт — жидкость с т. кип. 78,3°С это объясняется тем, что молекулы простых эфиров, не содержащие гидроксилов, в отличие от молекул спиртов не ассоциированы (см. Ассоциация). [c.140]
Физические свойства. Диметиловый и метилэтиловый эфиры в обычных условиях газы, а остальные — жидкости, кипящие при значительно более низких температурах, чем соответствующие им спирты. Все эфиры обладают приятным (эфирным) запахом. В воде низшие эфиры растворяются слабо, а высшие нерастворимы. Все эфиры растворяются в большинстве органических растворителей, и сами являются растворителями для большинства органических веществ. По удельному весу — все эфиры легче воды. [c.254]
По удельному весу — все эфиры легче воды. [c.254]
Водородные связи. Соединения, содержащие кислород-водородные или азот-водородные связи, обнаруживают признаки ассоциации, которая, если судить по молекулярному весу, дипольным моментам и молекулярной поляризуемости этих соединений, превышает все ожидания. К примеру, вода, у которой атомы не обладают высокой поляризуемостью, плавится при 0° и кипит при 100°, между тем как диметиловый эфир, метиловый спирт и ацетон-соединения с более высоким молекулярным весом — кипят при —24, 65 и 57° соответственно и плавятся при очень низких температурах. Нет большой разницы и в дипольных моментах этих веществ. Следовательно, исключительно высокая степень ассоциации воды должна объясняться каким-то коротко дистанционным взаимодействием, которое находит свое отражение не во всех макроскопических свойствах молекул воды. Из сопоставления физических свойств воды, метилового спирта и диметилового эфира следует, что гидроксильная группа имеет резко выраженное специфическое влияние на физические свойства. [c.161]
[c.161]
Диэфиры этиленгликолей применяются также в качестве растворителей. Вследствие присутствия в молекуле двух эфирных атомов кислорода физические свойства диэфиров как растворителей аналогичны свойствам диоксана, но температуры кипения их выше. Диэтиловый эфир этиленгликоля aHgO Hg HjO aHs кипит при 121° (760 мм рт. ст.), диэтиловый эфир диэтиленгликоля кипит при 188° (760 мм рт. ст.), а диметиловый эфир тетраэтиленгликоля — при 276° (760 мм рт. ст.). Диэтиловый эфир этиленгликоля растворим в воде. Максимальная концентрация раствора достигает 21%. Его добавляют к воде, чтобы облегчить растворимость веществ, в ней не растворяющихся. Последние два эфира смешиваются с водой во всех отношениях. Эфир диэтиленгликоля применяют при нанесении лакокрасочных покрытий кистью. Производное тетраэтиленгликоля используют как смазку для каучуковых изделий и в качестве растворителя для хлороргани-ческих хладагентов. [c.359]
Диметиловый эфир — газ с т. кип. —24 °С. Это соединение резко отличается от этилового спирта не только по своим физическим, но и по химическим свойствам. Оно не реагирует с металлическим натрием. Как и этиловый спирт, диметиловый эфир реагирует с иодистоводородной кислотой, но при этом образуется соединение, имеющее формулу h4I. Анализ диме-тилового эфира показывает, что углерод, водород и кислород содержатся в нем в том же соотношении, что и в этиловом спирте, а именно 2С 6Н 10. Его молекулярный вес такой же, как и этилового спирта, н равен 46. Таким образом, диметиловый эфир имеет ту же самую молекулярную формулу QHeO. [c.36]
кип. —24 °С. Это соединение резко отличается от этилового спирта не только по своим физическим, но и по химическим свойствам. Оно не реагирует с металлическим натрием. Как и этиловый спирт, диметиловый эфир реагирует с иодистоводородной кислотой, но при этом образуется соединение, имеющее формулу h4I. Анализ диме-тилового эфира показывает, что углерод, водород и кислород содержатся в нем в том же соотношении, что и в этиловом спирте, а именно 2С 6Н 10. Его молекулярный вес такой же, как и этилового спирта, н равен 46. Таким образом, диметиловый эфир имеет ту же самую молекулярную формулу QHeO. [c.36]
Физические свойства. Первые два представителя диметиловый эфир СН-—О—СНз метилэтиловый эфир СНд—О—С2Н5 — газы начиная с диэтило-Бого эфира — жидкости. Температура кипения эфиров ниже температур кипения соответствуюших спиртов, так как их молекулы ие ассоциированы за счет водородных связей. Они обладают приятным (эфирным) запахом, плохо растворимы Б воде, хорошо во многих органических растворителях. [c.113]
[c.113]
Для органических соединений характерно -явление изомерии. Известно очень много соединений, имеющих один и тот же состав, одинаковый молекулярный вес, но различную структуру молекул, а тем самым и различные физические и химические свойства. Примером могут служить соединения с эмпирической формулой С Н О. Этому составу отвечает формула этилового спирта СН3СН2ОН и диметилового эфира СНзОСНз. Составу С Н О, отвечают 20 различных веществ, относящихся к различным классам. [c.197]
Физические свойства. Диметиловый эфир СНз—О—СНз и метилэтиловый эфир СНз—О—С2Н5 при комнатной температуре — газообразные вещества начиная с дизтилового эфира, простые эфиры представляют собой бесцветные, легко подвижные жидкости. [c.127]
Существование древесното спирта как пндивидуального соединения было точно доказано работами Дюма и ПелигО, которые в 1835 г. опубликовали результаты своих исследований. Характерной чертой этих работ явилось то, что авторы исследовали свойства вновь открытого соединения в сопоставлении с хорошо известным винным спиртом. Они сравнивают физические свойства обоих спиртов, характер горения, растворимость в них различных веществ, реакции с металлическим калием и натрием, продукты хлорирования. Они устанавливают, что продукт перегонки метилового спирта с серной кислотой (диметиловый эфир) соответствует по способу образования и свойствам диэтиловому эфиру, а продукт взаимО дей-ствия с хлористым водородом (хлористый метил) аналогичен хлористому этилу. [c.9]
Они сравнивают физические свойства обоих спиртов, характер горения, растворимость в них различных веществ, реакции с металлическим калием и натрием, продукты хлорирования. Они устанавливают, что продукт перегонки метилового спирта с серной кислотой (диметиловый эфир) соответствует по способу образования и свойствам диэтиловому эфиру, а продукт взаимО дей-ствия с хлористым водородом (хлористый метил) аналогичен хлористому этилу. [c.9]
Физические свойства. Первые два представителя эфиров — диметиловый эфир Яг О — СНз и метилэтиловый эфир СН3— О — СгНб представляют собой при обычных условиях газообразные вещества. [c.136]
Диметиловый эфир – Что такое Диметиловый эфир?
9816
Диметиловый эфир (C2H6O) (метиловый эфир, метоксиметан, древесный эфир) Н3С-О-СН3 — широко применяемый на практике простой эфир.
Диметиловый эфир (C2H6O) (метиловый эфир, метоксиметан, древесный эфир) Н3С-О-СН3 – широко применяемый на практике простой эфир.
Бесцветный газ с характерным запахом, химически инертный.
Главные характеристики:
- температура плавления – (−138,5)°C,
- температура кипения – (−24,9)°C,
- плотность при нормальных условиях – 2,1098 кг/м³ (в 1,63 раза тяжелее воздуха),
- плотность в жидкой фазе – 0,668 г/см³,
- критическая температура – +127,0 °C,
- критическое давление – 53 атм,
- критическая плотность – 0,272 г/см³,
- растворимость в воде – 3700 мл/100 мл при 18 °C,
- растворим в метиловом и этиловом спирте, толуоле.
В промышленности диметиловый эфир производится из природного газа, угля или биомассы.
Используется в следующих сферах:
- для метилирования ароматических аминов,
- для получения диметилсульфата,
- в качестве пропеллента для аэрозольных баллонов,
- в качестве растворителя и экстрагента,
- как хладагент,
- как топливо для газовой сварки и резки,
- в качестве многоцелевого топлива.
Применение в качестве топлива
Диметиловый эфир – экологически чистое топливо без содержания серы, содержание оксидов азота в выхлопных газах на 90% меньше, чем у бензина.
Цетановое число диметилового дизеля более 55, при этом у классического нефтяного – 38-53.
Применение диметилового эфира не требует специальных фильтров, но необходима переделка систем питания (установка газобалонного оборудования, корректировка смесеобразования) и зажигания двигателя.
Без переделки возможно применение на автомобилях с LPG-двигателями при 30 % содержании в топливе.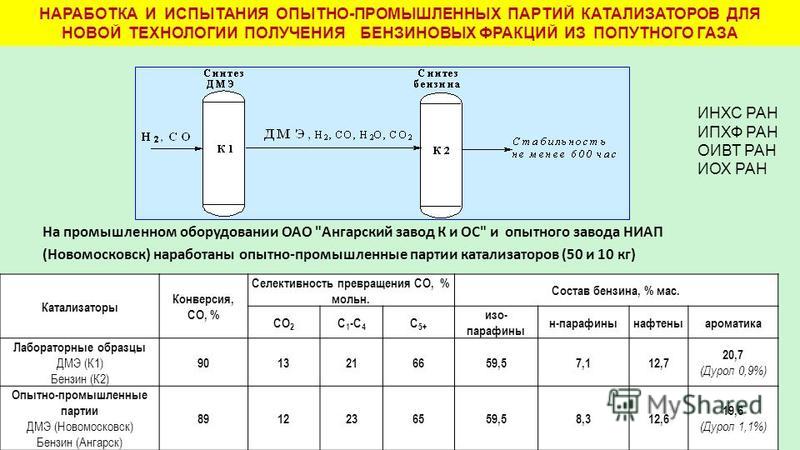
Теплота сгорания ДМЭ около 30 МДж/кг, у классических нефтяных топлив – около 42 МДж/кг.
Одна из особенностей применения ДМЭ – его более высокая окисляющая способность (благодаря содержанию кислорода), чем у классического топлива.
Является слабым наркотиком.
Огнеопасен: смесь с воздухом взрывоопасна, температура вспышки −41 °C.
ПДК в воздухе рабочей зоны составляет 200 мг/м³.
Диэтиловый эфир — свойства, получение и применение
Диэтиловый эфир. По химическим свойствам — типичный алифатический простой эфир. Широко используется в качестве растворителя. Впервые получен в Средние века.
| Диэтиловый эфир | |
|---|---|
| Систематическое наименование | Этоксиэтан |
| Хим. формула | C4H10O |
| Состояние | жидкость |
| Молярная масса | 74,12 г/моль |
| Плотность | 0,714 г/см³ |
| Энергия ионизации | 9,53 ± 0,01 эВ |
| Температура | |
| • плавления | -116,3 °C |
| • кипения | 34,65 °C |
| • разложения | 193,4 °C |
| • вспышки | −49 ± 1 °F |
| Пределы взрываемости | 1,9 ± 0,1 об. % % |
| Давление пара | 440 ± 1 мм рт.ст. |
| Растворимость | |
| • в воде | (для 20 °С) 6,5 г/100 мл |
| Рег. номер CAS | 60-29-7 |
| PubChem | 3283 |
| Рег. номер EINECS | 200-467-2 |
| SMILES | |
| InChI |
1S/C4h20O/c1-3-5-4-2/h4-4h3,1-2h4 RTZKZFJDLAIYFH-UHFFFAOYSA-N |
| RTECS | KI5775000 |
| ChEBI | 35702 |
| Номер ООН | 1155 |
| ChemSpider | 3168 |
| Пиктограммы ECB | |
| NFPA 704 | |
История
Возможно, что впервые диэтиловый эфир был получен в IX веке алхимиком Джабир ибн Хайяном либо алхимиком Раймундом Луллием в 1275 году. Достоверно известно, что он был синтезирован в 1540 году Валерием Кордусом, который назвал его «сладким купоросным маслом» (лат. oleum dulce vitrioli), поскольку получил его перегонкой смеси этилового спирта и серной кислоты, которая тогда называлась «купоросным маслом». Кордус также отметил его анестезирующие свойства. В 1680 году Роберт Бойль вторично синтезировал эфир. Затем в 1704 году Исаак Ньютон открыл эфир в третий раз, в поисках синтеза искусственного золота.
oleum dulce vitrioli), поскольку получил его перегонкой смеси этилового спирта и серной кислоты, которая тогда называлась «купоросным маслом». Кордус также отметил его анестезирующие свойства. В 1680 году Роберт Бойль вторично синтезировал эфир. Затем в 1704 году Исаак Ньютон открыл эфир в третий раз, в поисках синтеза искусственного золота.
Название «эфир» было дано этому веществу в 1729 году Фробениусом.
В 1794 году эфир был испытан для вдыханий с целью уменьшения болей, а в 1795 году Томас Беддоус создал Медицинский пневматический институт для лечения различных легочных заболеваний газами. Такие газы тогда называли «искусственным воздухом».
Синтез
Получают действием на этиловый спирт кислотных катализаторов при нагревании, например, перегонкой смеси этилового спирта и серной кислоты при температуре порядка 140—150 °C. Также получается как побочный продукт в производстве этилового спирта гидратацией этилена в присутствии фосфорной кислоты или 96—98 % серной кислоты при 65—75 °С и давлении 2,5 МПа. Основная часть диэтилового эфира образуется на стадии гидролиза этилсульфатов (95—100 °C, 0,2 МПа).
Основная часть диэтилового эфира образуется на стадии гидролиза этилсульфатов (95—100 °C, 0,2 МПа).
Свойства
- Бесцветная, прозрачная, очень подвижная, летучая жидкость со своеобразным запахом и жгучим вкусом.
- Растворимость в воде 6,5 % при 20 °C. Образует азеотропную смесь с водой (т. кип. 34,15 °C; 98,74 % диэтилового эфира). Смешивается с этанолом, бензолом, эфирными и жирными маслами во всех соотношениях.
- Легко воспламеняется, в том числе пары; в определённом соотношении с кислородом или воздухом пары эфира для наркоза взрывоопасны.
- Разлагается под действием света, тепла, воздуха и влаги с образованием токсичных альдегидов, пероксидов и кетонов, раздражающих дыхательные пути.
- Образующиеся пероксиды нестойки и взрывоопасны, они могут быть причиной самовоспламенения диэтилового эфира при хранении и взрыве при его перегонке «досуха»
По химическим свойствам диэтиловый эфир обладает всеми свойствами, характерными для простых эфиров, например, образует нестойкие оксониевые соли с сильными кислотами:
Образует сравнительно стабильные комплексные соединения с кислотами Льюиса: (C2H5)2O·BF3
Применение
Фармакология
В медицине используется в качестве лекарственного средства общеанестезирующего действия, так как его влияние на нейронные мембраны и свойство «обездвиживать» ЦНС очень специфично и полностью обратимо. Применяется в хирургической практике для ингаляционного наркоза, а в стоматологической практике — местно, для обработки кариозных полостей и корневых каналов зуба при подготовке к пломбированию.
Применяется в хирургической практике для ингаляционного наркоза, а в стоматологической практике — местно, для обработки кариозных полостей и корневых каналов зуба при подготовке к пломбированию.
В связи с медленным разложением диэтилового эфира, должны строго выдерживаться установленные сроки хранения. Для наркоза можно применять эфир только из склянок, открытых непосредственно перед операцией. По истечении каждых 6 месяцев хранения эфир для наркоза проверяют на соответствие требованиям. Использование технического эфира в этих целях не допускается.
Выдающийся отечественный хирург Н.И. Пирогов первым в истории медицины начал оперировать раненых с эфирным обезболиванием в полевых условиях и всего провел около десяти тысяч операций под эфирным наркозом.
Техника
- Применяется как растворитель нитратов целлюлозы в производстве бездымного пороха, природных и синтетических смол, алкалоидов.
- Применяется как теплоноситель в криогенной технике, реже как компонент для хладагентов.

- Применяется как экстрагент для разделения плутония и продуктов его деления при получении и переработке ядерного топлива, при выделении урана из руд.
- Применяется как компонент топлива в авиамодельных компрессионных двигателях.
- При запуске бензиновых двигателей внутреннего сгорания в суровых зимних условиях.
В СССР выпускалась пусковая жидкость «Арктика», небольшое количество заливалось во впускной коллектор через карбюратор при снятом воздушном фильтре. Для армии выпускался эфир в алюминиевой запечатанной гильзе, перед использованием гильза протыкалась штык-ножом или отвёрткой. За рубежом выпускается «жидкость для запуска в холодные дни» в аэрозольном баллоне. Состав: диэтиловый эфир, индустриальное масло, пропеллент.
Механизм запуска ДВС в этом случае по большей мере компрессионный: смесь эфира с воздухом воспламеняется от сжатия уже при степени сжатия порядка 5-6. Потерявшие компрессию по разным причинам двигатели могут делать несколько оборотов на эфире, но на бензине, тем не менее, не работают.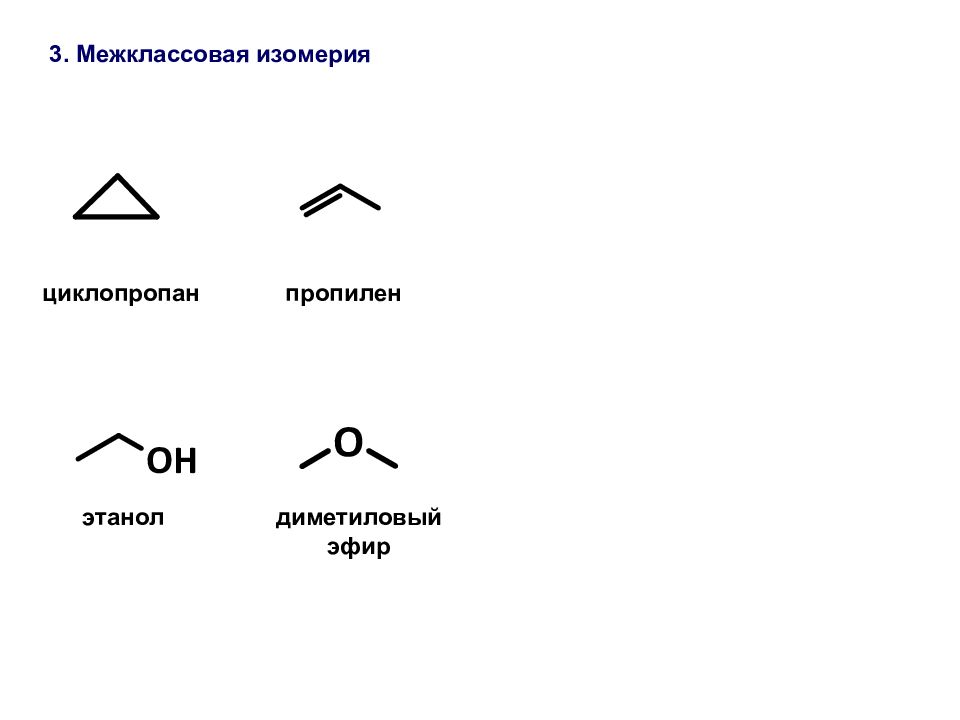
Свойства ДМЭ — Лаборатория топливоподающих систем
Диметиловый эфир (ДМЭ) является простейшим эфиром и имеет фор- мулу состава СН3-О-СН3 (или С2Н6О). При нормальных атмосферных условиях ДМЭ находится в газообразном состоянии, но ожижается уже при давлении 0,53 МПа. ДМЭ не токсичен и не загрязняет окружающую сре- ду. В 1987 году был подписан Монреальский протокол, запрещающий про- изводство озоноразрушающих соединений. ДМЭ имеет нулевой потенциал озоноразрушения в атмосфере – ODP. В 1997 году разработан Киотский про- токол, направленный на ограничение парникового эффекта нашей планеты. ДМЭ имеет нулевой потенциал глобального потепления — GWP.
Из-за соединения двух метиловых радикалов Ch4 атомом кислорода и его большой доли (около 35%), при сгорании в дизеле практически не обра- зуются сажа. Но из-за содержания кислорода ДМЭ имеет низкую теплоту сгорания.
Диметиловый эфир может быть получен из любого углеводородного сырья (в том числе — из биомассы), но основным сырьем для производства ДМЭ в России является природный газ и его продукт окисления — синтез-газ . Природный газ (метан CH4) реагирует с кислородом и водяным паром с образованием монооксида СО и диоксида СО2 углерода по реакциям:
Природный газ (метан CH4) реагирует с кислородом и водяным паром с образованием монооксида СО и диоксида СО2 углерода по реакциям:
CH4 + 1,5 О2 -> CO + 2 H2O;
CH4 + H2О -> 3 H2 + СO;
CO + H2О -> CО2 + H2 .
При последующем каталитическом синтезе из СО и СО2 через промежуточное получение метанола CН3OН образуется ДМЭ (CH3OCH3):
3 H2 + СО2 -> CН3OН + 2 H2O;
H2О + СО -> H2 + СO2;
2 CH3OH -> CH3OCH3 + H2O.
Пока промышленное производство ДМЭ осуществляется исключительно на стационарных установках. Однако быстрый прогресс в технологии производства ДМЭ (в частности, снижение давления синтеза с 32 до 9 МПа, переход на низкотемпературный катализатор и т. д.) может привести к появлению компактных реакторов ДМЭ, которые можно будет разместить на борту транспортного средства. Работы в этом направлении проводятся рядом зарубежных фирм, в частности фирмой Volvo .
д.) может привести к появлению компактных реакторов ДМЭ, которые можно будет разместить на борту транспортного средства. Работы в этом направлении проводятся рядом зарубежных фирм, в частности фирмой Volvo .
В последние годы все большее внимание исследователей привлекает использование ДМЭ в качестве экологически чистого топлива для дизелей. Исследованы его физико-химические свойства, процессы подачи, распыливания и сгорания, проведены безмоторные исследования систем подачи ДМЭ в дизель, экспериментальные исследования дизелей на ДМЭ и его смесях с другими топливами — жидкими (дизельное топливо, спирты, масла) и газообразными (природный газ, синтез-газ), оценены экологические качества дизелей, работающих на ДМЭ.
Применительно к разным процессам в ДВС актуальны свойства жидкого или газообразного ДМЭ, условий фазовых превращений, растворимости, химической активности и др.
В табл.1 приведены важнейшие для ДВС свойства ДМЭ, в частности, жидкого, дополненные для сравнения столбцом для традиционного дизельного топлива (ДТ). Некоторые из свойств требуют комментариев и конкретизации.
Некоторые из свойств требуют комментариев и конкретизации.
Таблица 1. Важнейшие физико-химические и моторные свойства ДМЭ и ДТ.
| Характеристика топлива | ДМЭ | ДТ |
| Молярная масса СnН1,8n | 46 | 190…220 |
| Содержание химических элементов массовое, %: — углерод | 52,2 | 86,6 |
| -водород | 13 | 13 |
| -кислород | 34,8 | 0,4 |
| Коэффициент сжимаемости истинный при 20 0С и 0,1 МПа, 1/Па | 157*10-11 | 67*10-11 |
| Плотность жидкой фазы при 20 0С, кг/м3 | 668 | 831…845 |
| Кинематическая вязкость (жидкость, 20 0С), мм2/с | 3 | 0,23 |
| Коэффициент поверхностного натяжения, Н/м | 0,0012 | 0,028 |
| Растворимость в воде при 20 0С, кг/м3 | 70 | — |
| Давление насыщенных паров при 20 0С, МПа | 0,53 | 0,0008 |
| Температура кипения (ожижения) при 0,1 МПа, 20 0С | -24,8 | 180…371 |
| Критическое давление/температура, МПа/К | 5,37/400 | — |
| Теплота парообразования при 20 0С, кДж/кг | 410 | 210…250 |
| Низшая теплотворная способность, МДж/кг | 28,84 | 42,5 |
| Запас энергии на борту автомобиля, МДж/л | 18,9 | 35,9 |
| Цетановое число | >55 | 40…55 |
| Стехиометрическое соотношение l0, кг/кг | 9,0 | 14,56 |
| Температура самовоспламенения, 0С | 235 | 240…310 |
| Выброс СО2 при полном сгорании, г/МДж | 67,5 | 74,2 |
Диметиловый эфир | 115-10-6
Химические свойства диметилового эфира, применение, производство
Химические свойства
Диметиловый эфир представляет собой сжиженный газ и существует в виде жидкости при комнатной температуре, когда он содержится под собственным давлением пара, или в виде газа при воздействии комнатной температуры и давления.
Это прозрачная бесцветная жидкость практически без запаха. При высоких концентрациях газ имеет слабый запах эфира.
использует
Диметиловый эфир используется в качестве растворителя в аэрозольных составах.использует
Метиловый эфир используется в качестве пропеллента аэрозолей и в холодильных установках.использует
Пропеллент аэрозольный; альтернативное дизельное топливо; химический промежуточный продукт.Определение
ChEBI: эфир, в котором атом кислорода связан с двумя метильными группами.Методы производства
Диметиловый эфир получают реакцией битуминозных или бурых углей с водяным паром в присутствии мелкодисперсного никелевого катализатора.В результате этой реакции образуется формальдегид, который затем восстанавливается до метанола и диметилового эфира. Диметиловый эфир можно также получить дегидратацией метанола.Общее описание
Диметиловый эфир – бесцветный газ со слабым эфирным запахом. Диметиловый эфир поставляется в виде сжиженного газа под давлением его паров. Контакт с жидкостью может вызвать обморожение. Диметиловый эфир легко воспламеняется. Его пары тяжелее воздуха. Любая утечка может быть жидкой или паровой.Диметиловый эфир может задыхаться при вытеснении воздуха. При длительном воздействии огня или сильной жары контейнеры могут сильно разорваться и взорваться.
Диметиловый эфир поставляется в виде сжиженного газа под давлением его паров. Контакт с жидкостью может вызвать обморожение. Диметиловый эфир легко воспламеняется. Его пары тяжелее воздуха. Любая утечка может быть жидкой или паровой.Диметиловый эфир может задыхаться при вытеснении воздуха. При длительном воздействии огня или сильной жары контейнеры могут сильно разорваться и взорваться.Реакции воздуха и воды
Легковоспламеняющиеся. При стоянии и на воздухе (кислороде) склонность к образованию взрывоопасных пероксидов. Когда эфиры, содержащие пероксиды, нагреваются (перегоняются), они могут взорваться [Lewis, 3-е изд., 1993, с. 854].Профиль реактивности
Диметиловый эфир представляет собой бесцветный легковоспламеняющийся газ (b.п. -24 ° C), малотоксичный. Очень опасная опасность пожара и взрыва при воздействии пламени, искр, тепла или сильных окислителей. Бурная реакция с гидридом алюминия, алюмогидридом лития. При стоянии и на воздухе (кислороде) склонность к образованию взрывоопасных пероксидов. Когда эфиры, содержащие пероксиды, нагреваются (перегоняются), они могут взорваться [Lewis, 3-е изд., 1993, с. 854].
Когда эфиры, содержащие пероксиды, нагреваются (перегоняются), они могут взорваться [Lewis, 3-е изд., 1993, с. 854].Опасность для здоровья
Метиловый эфир обладает низкой ингаляционной токсичностью у крыс. Caprino и Togna (1975) сообщили о 30-минутном значении LC50, равном 396 ppm для крыс.В смертельных дозах он вызывал седативный эффект, постепенное угнетение двигательной активности, потерю прицельного рефлекса, гипопноэ, кому и смерть у мышей. Воздействие 40% смеси метилового эфира с воздухом привело к первоначальному небольшому увеличению частоты сердечных сокращений у кроликов, за которым последовало снижение артериального давления. Смерть наступила через 45 минут. Было обнаружено, что артериальное и венозное парциальное давление кислорода снижается, в то время как венозное давление CO2 и pH крови повышаются.Reuzel et al. (1981) сообщили, что субхроническое вдыхание метилового эфира у крыс не вызывает значительных побочных эффектов.Заметного влияния на вес органов и тела, а также изменений, связанных с лечением, не наблюдалось.
 У людей неблагоприятный лечебный эффект от вдыхания этого соединения должен быть минимальным. Однако вдыхание чрезмерных количеств может вызвать интоксикацию и потерю сознания.
У людей неблагоприятный лечебный эффект от вдыхания этого соединения должен быть минимальным. Однако вдыхание чрезмерных количеств может вызвать интоксикацию и потерю сознания.Пожарная опасность
Поведение в огне: контейнеры могут взорваться. Пары тяжелее воздуха и могут распространяться на большое расстояние к источнику возгорания и вспыхивать обратно.Химическая реактивность
Реакционная способность с водой Нет реакции; Реакционная способность с обычными материалами: реакции нет; Устойчивость при транспортировке: стабильная; Нейтрализующие вещества для кислот и щелочей: не применимо; Полимеризация: не относится; Ингибитор полимеризации: не относится.Применение в фармацевтике
Диметиловый эфир можно использовать в качестве пропеллента аэрозолей для местных аэрозольных составов в сочетании с углеводородами и другими пропеллентами. Как правило, его нельзя использовать отдельно в качестве топлива из-за высокого давления пара. Диметиловый эфир является хорошим растворителем и обладает уникальным свойством высокой растворимости в воде по сравнению с другими пропеллентами. Он часто используется с водными аэрозолями. При использовании диметилового эфира в качестве пропеллента образуется крупнозернистый влажный аэрозоль.
Диметиловый эфир является хорошим растворителем и обладает уникальным свойством высокой растворимости в воде по сравнению с другими пропеллентами. Он часто используется с водными аэрозолями. При использовании диметилового эфира в качестве пропеллента образуется крупнозернистый влажный аэрозоль.Диметиловый эфир также используется в качестве пропеллента в косметических средствах, таких как лаки для волос, и в других аэрозольных продуктах, таких как освежители воздуха и спреи от мух.
Диметиловый эфир дополнительно используется в качестве хладагента.
Безопасность
Диметиловый эфир можно использовать в качестве пропеллента и растворителя в фармацевтических аэрозолях для местного применения, и при использовании в таких случаях он обычно рассматривается как практически нетоксичный и не вызывающий раздражения материал. Однако вдыхание паров диметилового эфира в высоких концентрациях вредно.Кроме того, контакт кожи с жидким диметиловым эфиром может привести к замерзанию кожи и сильному обморожению.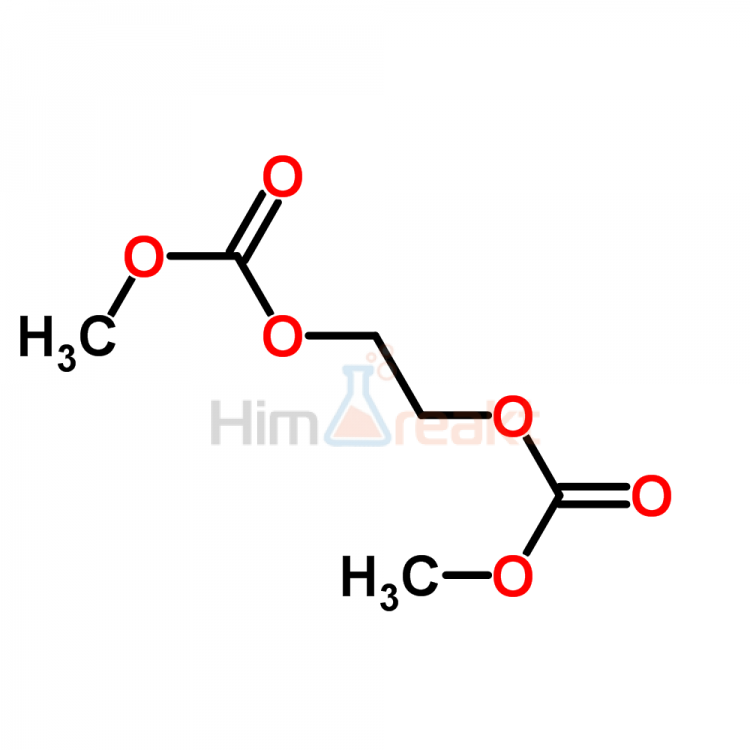
При использовании в составах для местного применения диметиловый эфир может оказывать охлаждающее действие на кожу, хотя при правильном применении пропеллент быстро испаряется и не вызывает раздражения.
LD50 (мышь, ингаляция): 386000 частей на миллион / 30 мин
LD50 (крыса, ингаляция): 308 г / м3
Канцерогенность
Пожизненное исследование на крысах не вызывают рак или явные, статистически значимые доказательства хроническая токсичность при 25 000 ppm диметилового эфира.склад
Сжиженный газ стабилен при использовании в качестве топлива. Однако длительное пребывание на воздухе может привести к медленному образованию взрывоопасных пероксидов.Растворы жидкого диметилового эфира нельзя концентрировать ни перегонкой, ни упариванием. Диметиловый эфир следует хранить в плотно закрытых металлических баллонах в прохладном сухом месте.
Методы очистки
Осушите метиловый эфир путем пропускания через оксид алюминия, а затем над BaO или над Cah3 с последующей фракционной перегонкой при низких температурах. Его растворимость составляет 37 мл на мл h3O при 18 °, и он хорошо растворим.
Его растворимость составляет 37 мл на мл h3O при 18 °, и он хорошо растворим.Несовместимость
Диметиловый эфир является агрессивным растворителем и может повлиять на материалы прокладок, используемых в аэрозольной упаковке. С диметиловым эфиром нельзя использовать окислители, уксусную кислоту, органические кислоты и ангидриды.Нормативный статус
Включен в базу данных неактивных ингредиентов FDA (аэрозоли для местного применения). Входит в состав непарентеральных препаратов, лицензированных в Великобритании.Включен в Канадский список допустимых немедикаментозных ингредиентов.Продукты и сырье для получения диметилового эфира
Сырье
Препараты
Диметиловый эфир (CAS 115-10-6) – Химические и физические свойства от Cheméo
Обратите внимание, что вам необходимо включить javascript, чтобы получить доступ ко всем свойствам. Вот как это сделать для Internet Explorer и Firefox.
Вот как это сделать для Internet Explorer и Firefox.Физические свойства
| Объект | Значение | Агрегат | Источник |
|---|---|---|---|
| PAff | 792,00 | кДж / моль | NIST |
| BasG | 764,50 | кДж / моль | NIST |
| Δ c H ° газ | -1460,40 ± 0,46 | кДж / моль | NIST |
| Δ f G ° | -139.04 | кДж / моль | Joback Рассчитанный объект |
| Δ f H ° газ | -184,10 ± 0,50 | кДж / моль | NIST |
| Δ фус H ° | 2,12 | кДж / моль | Joback Рассчитанный объект |
| Δ исп. H ° | 19,30 | кДж / моль | NIST |
| Δ исп. H ° | 18.50 | кДж / моль | NIST |
| IE | [9,80; 11,94] | эВ | |
| IE | 10,03 ± 0,03 | эВ | NIST |
| IE | 10,03 ± 0,03 | эВ | NIST |
| IE | 9,95 ± 0,07 | эВ | NIST |
| IE | 10,04 | эВ | NIST |
| IE | 9.80 ± 0,10 | эВ | NIST |
| IE | 9,80 | эВ | NIST |
| IE | 10,01 ± 0,01 | эВ | NIST |
| IE | 9,94 ± 0,01 | эВ | NIST |
| IE | 10,10 ± 0,20 | эВ | NIST |
| IE | 9,94 | эВ | NIST |
| IE | 9.96 ± 0,05 | эВ | NIST |
| IE | 10,00 ± 0,02 | эВ | NIST |
| IE | 10,00 | эВ | NIST |
| IE | 10,10 | эВ | NIST |
| IE | Выброс 11,94 | эВ | NIST |
| IE | 10,00 ± 0,20 | эВ | NIST |
| IE | 10.10 | эВ | NIST |
| IE | 10,03 | эВ | NIST |
| IE | 9,98 | эВ | NIST |
| IE | 10,05 | эВ | NIST |
| IE | 10,04 | эВ | NIST |
| IE | 10,04 | эВ | NIST |
| журнал P окт / ватт | 0.26 | Криппен Рассчитанный объект | |
| P c | [5264,00; 5800,00] | кПа | |
| P c | 5264,00 ± 15,00 | кПа | NIST |
| P c | 5359,00 ± 50,66 | кПа | NIST |
| P c | 5330,00 ± 60,79 | кПа | NIST |
| P c | 5400.00 ± 101,32 | кПа | NIST |
| P c | 5269,00 ± 40,53 | кПа | NIST |
| P c | 5400,00 ± 101,32 | кПа | NIST |
| P c | 5400,00 ± 151,99 | кПа | NIST |
| P c | Выброс 5800.00 ± 405.30 | кПа | NIST |
| S ° жидкость | 146.57 | Дж / моль × K | NIST |
| T кип. | [248,20; 249,50] | К | |
| T кип. | 248,20 | К | NIST |
| T кип. | 248,30 | К | NIST |
| T кип. | 248,45 | К | NIST |
| T кип. | 248.25 ± 1,00 | К | NIST |
| T кип. | 249,20 ± 0,40 | К | NIST |
| T кип. | 249,50 ± 0,60 | К | NIST |
| T c | [399,40; 402.80] | К | |
| T c | 399,40 ± 0,15 | К | NIST |
| T c | 400.33 ± 1,00 | К | NIST |
| T c | 400,10 ± 0,40 | К | NIST |
| T c | 400,10 ± 0,40 | К | NIST |
| T c | 399,70 ± 0,40 | К | NIST |
| T c | 399,40 ± 0,40 | К | NIST |
| T c | 400.05 ± 0,30 | К | NIST |
| T c | 402,80 ± 3,00 | К | NIST |
| T c | 400,30 ± 0,40 | К | NIST |
| T c | 400,00 ± 2,00 | К | NIST |
| T c | 402,80 ± 3,00 | К | NIST |
| T c | 402.80 ± 3,00 | К | NIST |
| T фус | 131,65 | К | NIST |
| T фус | 135,20 ± 2,00 | К | NIST |
| T тройной | 131,64 ± 0,05 | К | NIST |
| T тройной | 131,66 ± 0,06 | К | NIST |
| В c | 0.16 ± 0,00 | м 3 / кг-моль | NIST |
Свойства, зависящие от температуры
| Объект | Значение | Агрегат | Температура (К) | Источник |
|---|---|---|---|---|
| C p, газ | [62.01; 75,14] | Дж / моль × K | [272,20; 370,42] | |
| C p, газ | 62.01 | Дж / моль × K | 272.2 | NIST |
| C p, газ | 65,90 | Дж / моль × K | 300,76 | NIST |
| C p, газ | 70,33 | Дж / моль × K | 333,25 | NIST |
| C p, газ | 75,14 | Дж / моль × K | 370,42 | NIST |
| C p, жидкость | 102,30 | Дж / моль × K | 240.0 | NIST |
| η | 0,00 | Па × с | 267,58 | Joback Расчетная недвижимость |
| Δ фус H | 4,94 | кДж / моль | 131,66 | NIST |
| Δ фус H | 4,94 | кДж / моль | 131,7 | NIST |
| Δ фус H | 4,94 | кДж / моль | 131.7 | NIST |
| Δ исп. H | [21,10; 22,80] | кДж / моль | [209,50; 374,50] | |
| Δ пар H | 21,40 | кДж / моль | 209,5 | NIST |
| Δ исп. H | 22,80 | кДж / моль | 214,5 | NIST |
| Δ исп. H | 22.70 | кДж / моль | 221,5 | NIST |
| Δ исп. H | 22.60 | кДж / моль | 224,0 | NIST |
| Δ исп. H | 21,50 ± 0,10 | кДж / моль | 248,0 | NIST |
| Δ исп. H | 21,51 | кДж / моль | 248,3 | NIST |
| Δ исп. H | 21.51 | кДж / моль | 248,34 | NIST |
| Δ исп. H | 22,20 | кДж / моль | 272,0 | NIST |
| Δ исп. H | 21,20 | кДж / моль | 326,5 | NIST |
| Δ исп. H | 21,10 | кДж / моль | 374,5 | NIST |
| Δ фус S | 37.49 | Дж / моль × K | 131,66 | NIST |
| Δ исп. S | 86,61 | Дж / моль × K | 248,34 | NIST |
Молекулярные дескрипторы
| Группы Джобака и Рида | |
|---|---|
| -O- (без кольца) | 1 |
| -Ч4 | 2 |
Аналогичные соединения
Найдите другие соединения, похожие на Диметиловый эфир .
Примечание. Cheméo только индексирует данные, следуйте ссылкам на источники, чтобы получить самые свежие данные. Источник также предоставляет дополнительную информацию, такую как год публикации, авторов и многое другое.
Найдите время, чтобы проверить и дважды проверить источник данных.
Выброс Этот значок означает
значение отклоняется более чем на 2 стандартных отклонения от
имущество означает.
диметиловый эфир, 115-10-6
диметиловый эфир, 115-10-6Спонсоры поставщиков
Категория: растворители США / ЕС / FDA / JECFA / FEMA / FLAVIS / Ученый / Патентная информация: Физические свойства:
Органолептические свойства:
Косметическая информация: Поставщиков: Информация по безопасности:
Информация о безопасности использования:
Ссылки по безопасности: Ссылки: Другая информация: Примечание о потенциальных блендерах и основных компонентахВозможное использование: Происхождение (природа, еда, прочее): примечание.Синонимы:
Статей: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Не найдено | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
эфира | химическое соединение | Британника
Эфир , любой из класса органических соединений, характеризующихся атомом кислорода, связанным с двумя алкильными или арильными группами.Простые эфиры похожи по структуре на спирты, а простые эфиры и спирты похожи по структуре на воду. В спирте один атом водорода в молекуле воды заменен алкильной группой, тогда как в эфире оба атома водорода заменены алкильными или арильными группами.
При комнатной температуре эфиры представляют собой бесцветные жидкости с приятным запахом. По сравнению со спиртами простые эфиры обычно менее плотны, менее растворимы в воде и имеют более низкие температуры кипения. Они относительно инертны, и в результате их можно использовать в качестве растворителей для жиров, масел, восков, отдушек, смол, красителей, камедей и углеводородов.Пары некоторых эфиров используются в качестве инсектицидов, митицидов и фумигантов для почвы.
Эфиры также важны в медицине и фармакологии, особенно для использования в качестве анестетиков. Например, этиловый эфир (CH 3 CH 2 ―O ― CH 2 CH 3 ), известный просто как эфир, впервые был использован в качестве хирургического анестетика в 1842 году. Кодеин, сильнодействующее обезболивающее. , представляет собой метиловый эфир морфина. Поскольку эфир легко воспламеняется, его в основном заменили менее горючие анестетики, включая закись азота (N 2 O) и галотан (CF 3 CHClBr).
Этиловый эфир – отличный растворитель для экстракции и широкого спектра химических реакций. Он также используется в качестве летучей пусковой жидкости для дизельных двигателей и бензиновых двигателей в холодную погоду. Диметиловый эфир используется в качестве распыляемого пропеллента и хладагента. Метил t -бутиловый эфир (МТБЭ) – это добавка к бензину, которая повышает октановое число и снижает количество загрязняющих веществ, содержащих оксиды азота, в выхлопных газах. Простые эфиры этиленгликоля используются как растворители и пластификаторы.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасОбщие названия эфиров просто дают названия двух алкильных групп, связанных с кислородом, и добавляют слово эфир . Текущая практика заключается в перечислении алкильных групп в алфавитном порядке ( t -бутилметиловый эфир), но более старые названия часто перечисляют алкильные группы в порядке возрастания размера (метил t -бутиловый эфир). Если в названии описана только одна алкильная группа, это означает две идентичные группы, как в этиловом эфире для диэтилового эфира.
Систематические (IUPAC) названия для простых эфиров используют более сложную группу в качестве корневого названия с атомом кислорода и меньшей группой, названной в качестве заместителя алкокси. Приведенные выше примеры представляют собой этоксиэтан (диэтиловый эфир), метоксиэтан (метилэтиловый эфир), 2-метокси-2-метилпропан (МТВЕ) и феноксибензол (дифениловый эфир). Номенклатура IUPAC хорошо подходит для соединений с дополнительными функциональными группами, потому что другие функциональные группы могут быть описаны в корневом имени.
Физические свойства простых эфиров
В простых эфирах отсутствуют гидроксильные группы спиртов.Без сильно поляризованной связи O ― H молекулы эфира не могут образовывать водородные связи друг с другом. Однако простые эфиры имеют несвязывающие электронные пары на своих атомах кислорода, и они могут образовывать водородные связи с другими молекулами (спиртами, аминами и т. Д.), Которые имеют связи O ― H или N ― H. Способность образовывать водородные связи с другими соединениями делает простые эфиры особенно хорошими растворителями для широкого ряда органических соединений и удивительно большого числа неорганических соединений. (Для получения дополнительной информации о водородной связи, см. химическая связь: Межмолекулярные силы.)
Поскольку молекулы эфира не могут вступать в водородные связи друг с другом, они имеют гораздо более низкие точки кипения, чем спирты с аналогичной молекулярной массой. Например, точка кипения диэтилового эфира (C 4 H 10 O, молекулярная масса [MW] 74) составляет 35 ° C (95 ° F), но точка кипения 1-бутанола (или n -бутиловый спирт; C 4 H 10 O, MW 74) составляет 118 ° C (244 ° F). Фактически, температуры кипения простых эфиров намного ближе к температурам кипения алканов с аналогичной молекулярной массой; точка кипения пентана (C 5 H 12 , MW 72) составляет 36 ° C (97 ° F), что близко к температуре кипения диэтилового эфира.
Комплексы простых эфиров с реагентами
Уникальные свойства простых эфиров (то есть, что они сильно полярны, с несвязывающими электронными парами, но без гидроксильных групп) способствуют образованию и использованию многих реагентов. Например, реактивы Гриньяра не могут образоваться, если не присутствует эфир, разделяющий свою неподеленную пару электронов с атомом магния. Комплексообразование с атомом магния стабилизирует реактив Гриньяра и помогает удерживать его в растворе.
Электронодефицитные реагенты также стабилизируются простыми эфирами.Например, боран (BH 3 ) является полезным реагентом для получения спиртов. Чистый боран существует в виде его димера, диборана (B 2 H 6 ), токсичного газа, который неудобен и опасен в использовании. Однако боран образует стабильные комплексы с простыми эфирами, и его часто используют в виде жидкого комплекса с тетрагидрофураном (ТГФ). Точно так же газообразный трифторид бора (BF 3 ) легче использовать в виде его жидкого комплекса с диэтиловым эфиром, называемого эфиратом BF 3 , а не в качестве токсичного коррозионного газа.
Краун-эфиры – это специализированные циклические полиэфиры, которые окружают определенные ионы металлов с образованием коронообразных циклических комплексов. Они названы с использованием родительского имени корона , которому предшествует число, описывающее размер кольца, за которым следует количество атомов кислорода в кольце. В комплексе краун-эфир ион металла попадает в полость краун-эфира и сольватируется атомами кислорода. Внешний вид комплекса неполярный, маскируется алкильными группами краун-эфира.Многие неорганические соли можно сделать растворимыми в неполярных органических растворителях путем образования комплекса с подходящим краун-эфиром. Ионы калия (K + ) образуют комплекс с 18-краун-6 (18-членное кольцо с 6 атомами кислорода), ионы натрия (Na + ) с 15-краун-5 (15-членное кольцо, 5 атомов кислорода). ), и ионы лития (Li + ) по 12-краун-4 (12-членное кольцо, 4 атома кислорода).
В каждом из этих комплексов краун-эфир только катион сольватирован краун-эфиром.В неполярном растворителе анион не сольватируется, а уносится в раствор катионом. Эти «голые» анионы в неполярных растворителях могут быть гораздо более активными, чем в полярных растворителях, которые сольватируют и экранируют анион. Например, 18-краун-6 комплекс перманганата калия, KMnO 4 , растворяется в бензоле с образованием «пурпурного бензола» с чистым ионом MnO 4 – , действующим как мощный окислитель. Точно так же чистый ион – OH в гидроксиде натрия (NaOH), растворимый в гексане (C 6 H 14 ) с помощью 15-краун-5, является более мощным основанием и нуклеофилом, чем при сольватировании полярные растворители, такие как вода или спирт.
(PDF) Уравнение состояния для термодинамических свойств диметилового эфира
9J. Т. Ву, Б. Ван, Л. М. Юань и З. Г. Лю, J. Eng. Phys. Термофиз.
27, 748 共 2006 兲.
10 J. T. Wu и J. G. Yin, J. Chem. Англ. Данные 53, 2247 共 2008 兲.
11 J. G. Yin, J. T. Wu, Fluid Phase Equilib. 298, 298 2010 兲.
12 E. C. Ihmels, E. W. Lemmon, Fluid Phase Equilib. 260,36 2007 兲.
13 Р. М. Кеннеди, М. Сагенкан, Дж. Г. Астон, J.Являюсь. Chem. Soc. 63,
2267 共 1941 兲.
14 H. A. Duarte-Garza, J. W. Magee, Int. J. Thermophys. 18, 173
共 1997 兲.
15 W. Wagner, Cryogenics 13, 470–1973.
16 О. Маасс, Э. Х. Бумер, J. Am. Chem. Soc. 44, 1709–1922 гг.
,17, J. A. Nelder, R. Mead, Comput. J. 7, 308 1965.
18 Р. Спан, Многопараметрические уравнения состояния – точный источник данных о термодинамических свойствах
共 Springer, Berlin, 2000.
19 р.Т. Якобсен, С. Г. Пенончелло и Э. В. Леммон, в Experimental
Thermodynamics, под редакцией Дж. В. Сенгерса, Р. Ф. Кайзера и К. Дж. Петерса
共 Elsevier, Amsterdam, 2000, Vol. 5, стр. 35.
20 П. Дж. Мор, Б. Н. Тейлор и Д. Б. Ньюэлл, Rev. Mod. Phys. 80, 633
共 2008 兲.
21 U. Setzmann, W. Wagner, J. Phys. Chem. Ref. Данные 20, 1061 共 1991 兲.
22 E. W. Lemmon, R. T. Jacobsen, J. Phys. Chem. Ref. Данные 34,68
共 2005 兲.
23 E.W. Lemmon, M.O. McLinden и W. Wagner, J. Chem. Англ. Данные
54, 3141 共 2009 兲.
24 R. Span, W. Wagner, Int. J. Thermophys. 18, 1415 共 1997 兲.
25 S. L. Outcalt, M. O. McLinden, Ind. Eng. Chem. Res. 46, 8264
共 2007 兲.
26 A. Arteconi, G. D. Nicola, M. Moglie, G. Santori и R. Stryjek, J.
Therm Anal. Калорим. 97 631 2009 兲.
27 A. Arteconi, G. D. Nicola, G. Santori и R. Stryjek, J. Chem. Англ. Данные
54, 1840 共 2009 兲.
28 Э. Г. Ричардсон, Р. И. Тейт, Philos. Mag. 2, 441 共 1957 兲.
29 K. Tanaka, Y. Higashi, J. Chem. Англ. Данные 55, 2658 共 2010 兲.
30 U. K. Deiters, K. M. de Reuck, Pure Appl. Chem. 69, 1237 共 1997 兲.
31 А. Надеждин, Бейбл. Аня. Phys. 7, 678 共 1883 兲.
32 A. Leduc и P. Sacerdote, Seances Acad. Sci. 125 397 共 1897 兲.
33 Э. Бринер и Э. Кардосо, Seances Acad. Sci. 144 911 1907 兲.
34 E. Briner and E. Cardoso, J. Chim.Phys. Phys.-Chim. Биол. 6, 641
共 1908 兲.
35 E. Cardoso и A. Bruno, J. Chim. Phys. Phys.-Chim. Биол. 20, 347
共 1923 兲.
,, 36, E. Cardoso, A. A. Coppola, J. Chim. Phys. Phys.-Chim. Биол. 20, 337
共 1923 兲.
37 C. A. Winkler, O. Maass, Can. J. Res. 6, 458 共 1932 兲.
38 C. A. Winkler, O. Maass, Can. J. Res. 9, 613 共 1933 兲.
39 J. S. Tapp, E. W. R. Steacie, O. Maass, Can. J. Res. 9, 217 共 1933 兲.
40 Дж.Эдвардс и О. Маасс, Can. J. Res., Sect. А 12, 357 共 1935 兲.
41 D. B. Pall, O. Maass, Can. J. Res., Sect. B 14,96 共 1936 兲.
42 Б. Осипюк, Р. Стрыйек, Бюл. Акад. Pol. Наук, сер. Sci. Чим. 18, 289
共 1970 兲.
43 А. К. Завиша, С. Гловка, Bull. Акад. Pol. Наук, сер. Sci. Чим. 18,
549 共 1970 兲.
44 Дж. Р. Ноулс и Дж. А. Цольвег, Равновесие в жидкой фазе. 66 275 1991 兲.
45 J. R. Noles и J. A. Zollweg, J. Chem. Англ.Данные 37,306 1992 兲.
46 A. P. Kudchadker, D. Ambrose, C. Tsonopoulos, J. Chem. Англ. Данные
46, 457 共 2001 兲.
47 M. Yasumoto, Y. Uchida, K. Ochi, T. Furuya, and K. Otake, J. Chem.
англ. Данные 50,596 共 2005 兲.
48 С. Гловка, Бюл. Акад. Pol. Наук, сер. Sci. Чим. 20, 163 共 1972 兲.
49 C. Y. Tsang и W. B. Streett, J. Chem. Англ. Данные 26,155 共 1981 兲.
,, 50, E. Chang, J. C. G. Calado, W. B. Streett, J. Chem. Англ. Данные 27,293
共 1982 兲.
51 Х. Прейс и К. Моерке, Leuna Protocol, 1984, стр. 11141.
52 J. C. G. Calado, L. P. N. Rebelo, W. B. Streett, J. A. Zollweg, J.
Chem. Термодин. 18, 931 共 1986 兲.
53 Х. Холлдорф и Х. Кнапп, Равновесие в жидкой фазе. 40,113 1988 兲.
54 Х. Прейс, Д. Папе и С. Стоук, Leuna Protocol, 1991, стр. 6041.
,, 55, M.E. Pozo de Fernandez, J.C.G. Calado, J.A. Zollweg, W.B.
,Streett, Fluid Phase Equilib. 74, 289 1992 兲.
56 Т. Цудзимото, Х. Кубота, Ю. Танака, С. Мацуо и Т. Сотани, 13-я Япония
Симпозиум по теплофизическим свойствам, Токио, Япония, 1992.
57 А. Джонассон, О. Перссон, и P. Rasmussen, J. Chem. Англ. Данные 40,1209
共 1995 兲.
58 A. Jonasson, O. Persson, A. Fredenslund, J. Chem. Англ. Данные 40,
296 共 1995 兲.
59 S. Bobbo, R. Camporese, R. Stryjek и S. K. Malanowski, J. Chem.
англ. Данные 45, 829 共 2000 兲.
60 с.Боббо, Л. Феделе, Р. Кампорезе и Р. Стрыйек, Равновесие в жидкой фазе.
174,3 共 2000 兲.
61 Н. Ф. Джайлс и Г. М. Уилсон, J. Chem. Англ. Данные 45 146 共 2000 兲.
62 М. Теодореску и П. Расмуссен, J. Chem. Англ. Данные 46 640 共 2001 兲.
,, 63, L. J. Florusse, T. Fornari, S. B. Bottini, C. J. Peters, J. Supercrit.
Жидкости 22,1 2002 兲.
64 С. Боббо, Л. Феделе, Р. Кампорезе и Р. Стрыйек, Равновесие в жидкой фазе.
199, 153 共 2002 兲.
65 т.Лаурсен, П. Расмуссен и С.И. Андерсен, Can. J. Chem. 47,198
共 2002 兲.
,, 66, H. Daiguji, E. Hihara, J. Chem. Англ. Данные 48, 266 共 2003 兲.
67 С. Боббо, Л. Феделе, М. Скаттолини, Р. Кампорезе и Р. Стрыйек, Fluid
Phase Equilib. 224,119 2004 兲.
68 С. Боббо, М. Скаттолини, Л. Феделе и Р. Кампорезе, J. Chem. Англ.
Данные 50, 1667 共 2005 兲.
69 L. Fedele, S. Bobbo, V. D. Stefani, R. Camporese и R. Stryjek, J.
Chem.Англ. Данные 50, 128 共 2005 兲.
70 А. Вальц, Л. Гикель, К. Кокле, Д. Ричон, Равновесие в жидкой фазе.
230, 184 共 2005 兲.
71 Ф. Корваро, Г. Д. Никола, Ф. Полонара и Г. Сантори, J. Chem. Англ. Данные
51, 1469 共 2006 兲.
72 J. Im, G. Lee, J. Lee и H. Kim, J. Chem. Термодин. 38,1510 共 2006 兲.
73 Дж. Им, Г. Ли, Дж. Ли и Х. Ким, Равновесие в жидкой фазе. 251,59 2007 兲.
74 S.-J. Парк, К.-Дж. Han, and J. Gmehling, J. Chem. Англ.Данные 52, 1814
共 2007 兲.
75 A. V. Grosse, R. C. Wackher, C. B. Linn, J. Phys. Chem. 44, 275
共 1940 兲.
76 Р. Д. Маллеманн, Ф. Саннер, А. Малевернь, Seances Acad. Sci.
232, 1385 共 1951 兲.
77 Т. Б. Трипп, Р. Д. Данлэп, J. Phys. Chem. 66, 635 共 1962 兲.
78 К. П. Лоули и Л. Э. Саттон, Trans. Faraday Soc. 59, 2680 共 1963 兲.
79 W. S. Haworth, L. E. Sutton, Trans. Faraday Soc. 67, 2907 共 1971 兲.
80 л.Wu, C. Wang, X. Hu, H. Li и S. J. Han, J. Chem. Термодин. 38,
889 共 2006 兲.
81 W. Cawood и H. S. Patterson, J. Chem. Soc. 33 619 1933 兲.
82 Т. Б. Трипп, М.С. диссертация, Университет штата Мэн, 1961.
83 С. К. К. Джаткар, J. Indian Inst. Sci. П. Научный. 22,19 共 1939 兲.
,, 84, G. B. Kistiakowsky, W. W. Rice, J. Chem. Phys. 8 618 共 1940 兲.
85 М. Миядзаки, Х. Кубота, Ю. Танака и С. Мацуо, 12-й Японский симпозиум
sium по теплофизическим свойствам, Токио, Япония, 1991.
023104-16 WU, ZHOU, AND LEMMON
J. Phys. Chem. Ref. Данные, Vol. 40, No. 2, 2011
Эта статья защищена авторским правом, указанным в статье. Повторное использование содержимого AIP регулируется условиями по адресу: http://scitation.aip.org/termsconditions. Загружено на IP:
129.6.105.191 On: Tue, 30 Dec 2014 17:29:03
Диметиловый эфир
Диметиловый эфирВ. Адди Маевски
Это предварительный просмотр статьи, ограниченный некоторым исходным содержанием. Для полного доступа требуется подписка DieselNet.
Пожалуйста, войдите в систему , чтобы просмотреть полную версию этого документа.
Abstract : Диметиловый эфир (DME) может быть получен из разнообразного ископаемого сырья, включая природный газ и уголь, а также из возобновляемой биомассы. Спецификации для топливного DME были выпущены ISO и несколькими национальными органами по стандартизации. При использовании в качестве дизельного топлива DME обеспечивает снижение выбросов PM и NOx. Выбросы CO и HC, которые могут увеличиваться при использовании ДМЭ, можно легко контролировать с помощью катализатора окисления.
Введение
Диметиловый эфир (ДМЭ) – это простейший эфир, состоящий из двух метильных групп, связанных с центральным атомом кислорода, что выражается его химической формулой: CH 3 -O-CH 3 , рис. 1. ДМЭ можно получить из природного газа. – обеспечение альтернативного способа его использования в конкуренции с такими технологиями, как синтетическое топливо Фишера-Тропша, а также из другого углеродсодержащего сырья, включая уголь и различные виды биомассы. DME заменил CFC-газы (фреоны) в качестве экологически чистого и безопасного аэрозольного пропеллента, что является одним из его основных текущих приложений.Потенциальные будущие применения ДМЭ включают альтернативное автомобильное топливо, заменитель других видов топлива в производстве электроэнергии и в домашнем хозяйстве, а также источник водорода для топливных элементов [777] [3644] . Мировое производство ДМЭ выросло со 100 000–150 000 тонн в год в 1990-е годы [153] годы до примерно 200 000 тонн в середине 2000-х годов [1653] годов. Китай создал крупную производственную базу DME, которая, как сообщается, составляет почти 9 миллионов тонн в год при установленной мощности [1655] DME.
Рисунок 1 . Схематическое изображение молекулы DMEОбладая химической структурой, отчасти похожей на метанол, ДМЭ содержит кислород и не содержит углерод-углеродных связей, что серьезно ограничивает возможность образования выбросов углеродистых частиц во время сгорания. Однако, в отличие от метанола, ДМЭ имеет достаточно высокое цетановое число, чтобы хорошо работать в качестве топлива с воспламенением от сжатия. Также в отличие от метанола, ДМЭ представляет собой газ при температуре и давлении окружающей среды, поэтому он должен храниться под давлением в виде жидкости, подобной СНГ (сжиженный нефтяной газ).При использовании в качестве дизельного топлива DME снижает выбросы PM и NOx, но увеличивает CO и HC. Предварительные исследования, проведенные в 1990-х годах, пришли к выводу, что можно достичь выбросов ULEV в Калифорнии в легковых автомобилях, используя правильно спроектированную систему впрыска топлива DME с двигателем HSDI и катализатором окисления [773] .
Физические свойства DME (плотность, вязкость, смазывающая способность и т. Д.) Настолько отличаются от дизельного топлива, что вся топливная система должна быть перепроектирована [774] .Хотя DME может снизить выбросы по сравнению с дизельным топливом, снижение выбросов достигается за счет определенного уровня сложности системы хранения и впрыска топлива, включая необходимость наличия на борту транспортного средства топливного бака под давлением. Кроме того, у топлива ДМЭ отсутствует налаженная инфраструктура снабжения и заправки топливом. Следовательно, топливо DME с большей вероятностью будет использоваться в определенных нишевых приложениях, а не станет широкой альтернативой жидкому дизельному топливу.
В альтернативном методе использования DME может быть смешан с пропаном для использования в двигателях с искровым зажиганием, работающих на сжиженном нефтяном газе.Смеси DME-LPG использовались в Китае – стране с большой производственной базой DME, – где DME также добавлялся в городской газ, поставляемый для бытового использования.
OME Fuels. Полиоксиметилендиметиловые эфиры – сокращенно OME, PODE или POMDME – представляют собой класс производных DME, которые включают несколько оксиметиленовых (-O-CH 2 -) групп в молекуле с химической формулой CH 3 (-O-CH 2 ) n -O-CH 3 (Рисунок 2). Компоненты OME с n равным 3-4 были испытаны в качестве топлива для дизельных двигателей [3646] .Как и DME, топливо OME отличается отсутствием сажи при сгорании.
Рисунок 2 . Схематическое изображение молекулы OME 3Из-за их более высокой молекулярной массы и температуры кипения соединения OME также могут быть добавлены в дизельное топливо.



 Интенсивно Реагирует с сильными окислителями.
Интенсивно Реагирует с сильными окислителями.
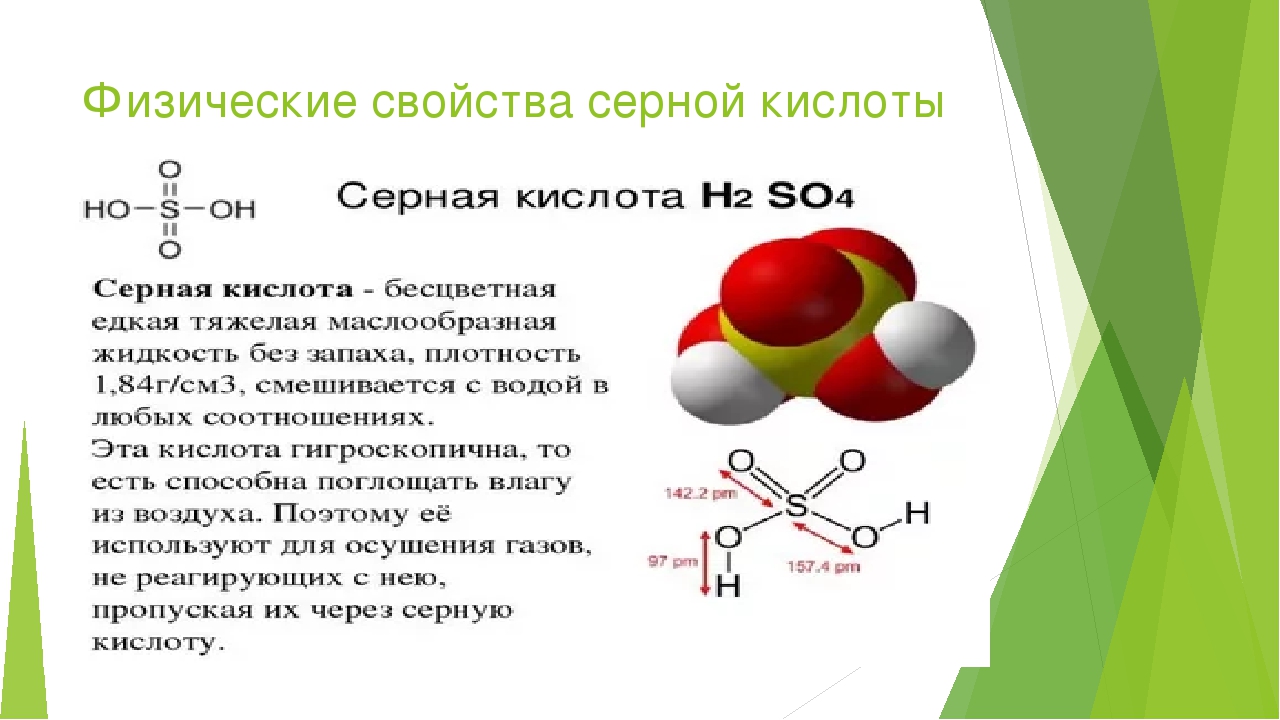
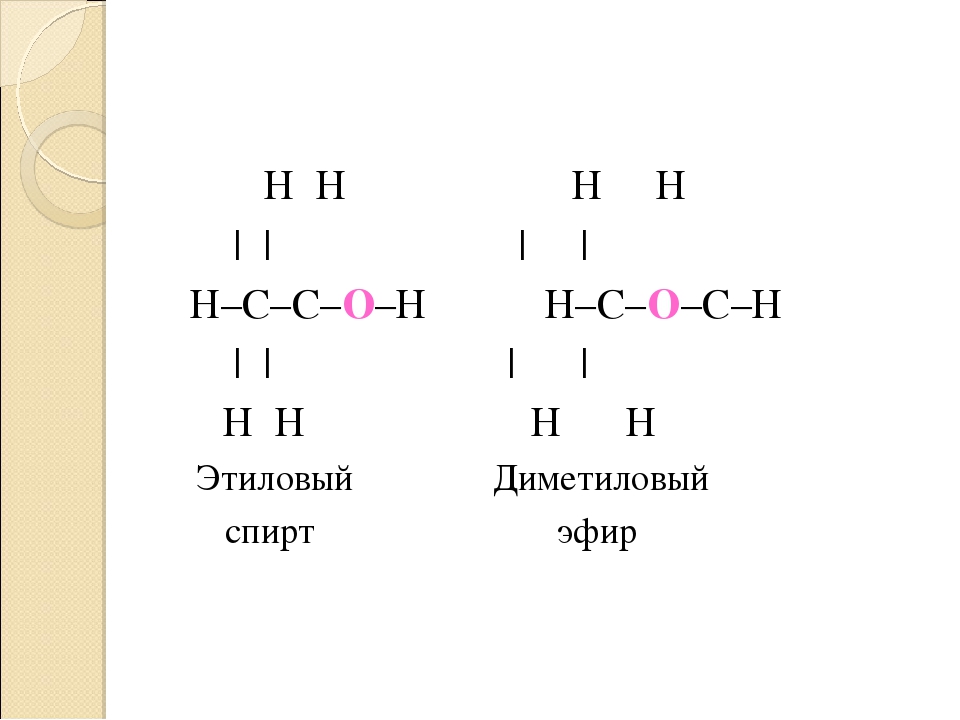
Добавить комментарий