Аквапорины вид транспорта: Презентация на тему: Виды транспорта
Аквапорины – Неврология — LiveJournal
СПРАВОЧНИК НЕВРОЛОГА
ВВЕДЕНИЕ
Вода составляет примерно 70% массы большинства живых организмов. Однако содержание ее внутри и вне клетки различно, и, как ни странно, клетка вынуждена строго регулировать поступление этого «универсального» растворителя. Этой цели служат специальные белки клеточной мембраны – аквапорины.
Зачем же клетке так тщательно заботиться о количестве такого, казалось бы, безвредного вещества, как вода? Оказывается, регуляция водного баланса внутри клеток влияет на их способность выполнять специфическую функцию, необходимую для жизни всего организма. Регулируя поступление воды и тем самым свой объем, нервные клетки, например, влияют на состояние ионных каналов, передающих нервные импульсы.
Концентрация солей, жиров, белков и углеводов внутри клетки превышает таковую снаружи, а это значит, что относительное количество воды в ней меньше, чем в тканевых жидкостях. Клетка испытывает постоянное давление воды, которому должна сопротивляться в течение всей жизни. Если сравнить под микроскопом мертвую и живую клетки из одной и той же ткани, можно сразу же заметить, что мертвая значительно больше: это вода вошла внутрь и «раздула» ее (Laesus De Liro – аналогия – отек ткани, клеток, головного мозга на фоне острой очаговой ишемии [инфаркта ткани мозга] или диффузный отек [набухание] головного мозга на фоне острых метаболических нарушений и т.д.).
Клетка испытывает постоянное давление воды, которому должна сопротивляться в течение всей жизни. Если сравнить под микроскопом мертвую и живую клетки из одной и той же ткани, можно сразу же заметить, что мертвая значительно больше: это вода вошла внутрь и «раздула» ее (Laesus De Liro – аналогия – отек ткани, клеток, головного мозга на фоне острой очаговой ишемии [инфаркта ткани мозга] или диффузный отек [набухание] головного мозга на фоне острых метаболических нарушений и т.д.).
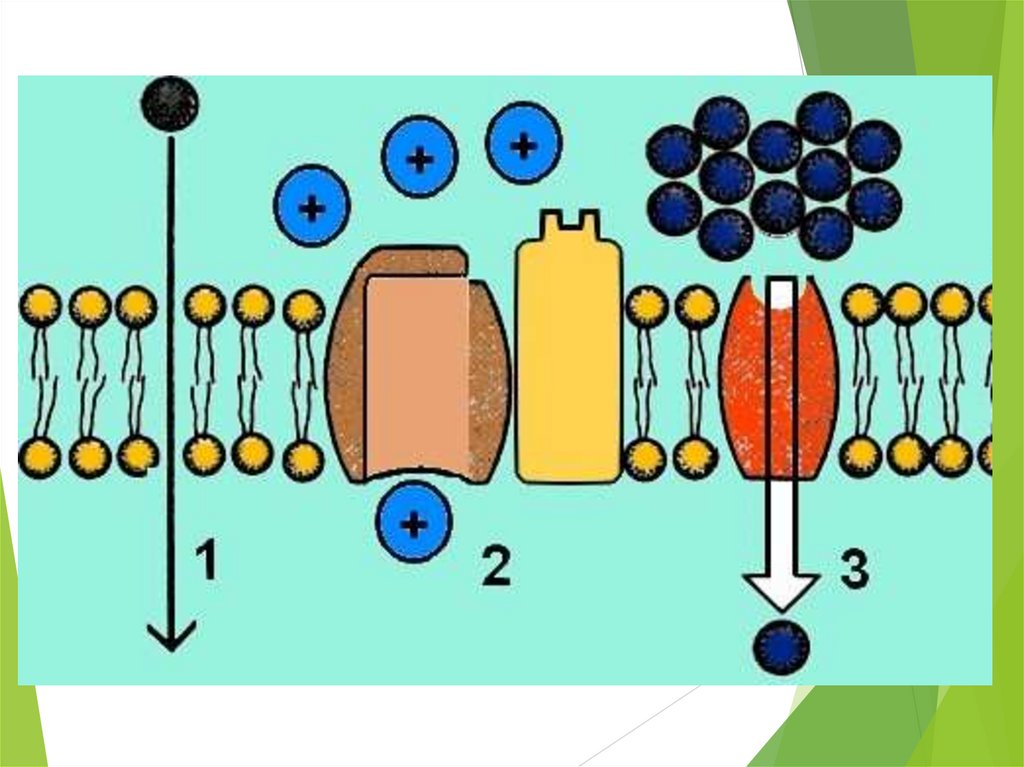
Хотя некоторое количество воды способно пассивно (простой диффузией) проникать через липидные слои, составляющие основу клеточных мембран (а также путем котранспорта через транспортеры электролитов и глюкозы), скорость и интенсивность такого водообмена явно недостаточна. Следовательно, клетке необходим специальный механизм для регуляции водных потоков. Такой механизм должен к тому же быть очень специфичным, чтобы вместе с молекулой воды не проникали вредные водорастворимые (гидрофильные) соединения, которые могут повредить ДНК, клеточные белки, либо блокировать внутриклеточные реакции.
Удовлетворению этих потребностей служит семейство мембранных каналообразующих белков (специфические системы транспорта воды), которые обеспечивают быстрый транспорт воды через биологические мембраны. Эти белки называют аквапоринами, они обнаружены у всех живых организмов. Открыты аквапорины были 30 лет назад, и с тех пор исследователи со всего мира пристально изучают их структуру и функции.
СТРУКТУРА АКВАПОРИНОВ
Существование водных каналов, пронизывающих мембраны клеток, постулировалось различными авторами с 1950-х годов, но молекулярные механизмы трансмембранного движения воды оставались неясными до работ P. Agre, который в 1988 г. открыл внутримембранный белок массой 28 kDa, идентифицированный как аквапорин 1 (AQP1). В 2003 г. P. Agre за исследование водных каналов была присуждена Нобелевская премия. Сегодня известно около 200 различных аквапоринов (Agre P. et al., 2003), формирующих водные каналы в клеточных мембранах всех живых существ. Нумерация аквапоринов, начиная с AQP 1, связана с последовательностью их открытия.
Аквапорины – гидрофобные трансмембранные белки (отдельные мономеры) массой от 26 до 34 kDa, формирующие гомотетрамеры. Отдельные мономеры состоят в среднем из 270 аминокислотных остатков (Титовец, 2007). Каждый мономер формирует отдельную водную пору. Проницаемость мономеров не меняется при их ассоциации в [гомо]тетрамер. В центре тетрамера также имеется пора, роль которой окончательно не установлена. Имеются предположения, что пора представляет собой лиганд-зависимый ионный канал.
Полипептидная цепь мономера пронизывает мембрану шесть раз, N- и C-концы обращены внутрь клетки. Концевые участки являются мишенями посттрансляционной модификации. Участки цепи, находящиеся в мембране (т.е. пронизывающие мембрану шесть раз) образуют 6 α-спиралей, которые наклонены под углом примерно 25 градусов по отношению к плоскости мембраны. Между N- и C-половинами молекулы наблюдается высокая степень гомологии, что может быть следствием древней дупликации аквапоринового гена. На соединительных петлях B и E практически у всех представителей семейства аквапоринов имеется консервативный мотив, состоящий из 3 аминокислот: аспарагина, пролина и аланина (NPA-мотив). Петли B и Е несут короткие α-спиральные домены, которые погружены в мембрану. Эти домены принимают участие в формировании высокоселективного канала для воды (проницаемость аквапоринов высока: 3х10*9 молекул воды в секунду на мономер, но при этом очень избирательна). Данная модель мономера аквапоринов получила название модели «песочных часов» (hourglass model).
Петли B и Е несут короткие α-спиральные домены, которые погружены в мембрану. Эти домены принимают участие в формировании высокоселективного канала для воды (проницаемость аквапоринов высока: 3х10*9 молекул воды в секунду на мономер, но при этом очень избирательна). Данная модель мономера аквапоринов получила название модели «песочных часов» (hourglass model).
Подробнее о строении и функционировании аквапоринов в следующих источниках:
статья «Лауреаты Нобелевской премии 2003 года по химии (Нобелевская премия по химии за 2003 г. присуждена Р. Мак-Киннону и П. Эгру за открытия, касающиеся переноса ионов и молекул воды через клеточную мембрану)» Белянова Л.П., кандидат химических наук, Москва (журнал «Природа» №1, 2004) [читать] или [читать];
сообщение «Аквапорины – белки водных каналов» Новости науки, 15.09.02 (scientific.ru) [читать] или [читать];
статья (обзор) «Аквопорины и гипервазопрессинеия» И.Н. Кабанов, Л.П.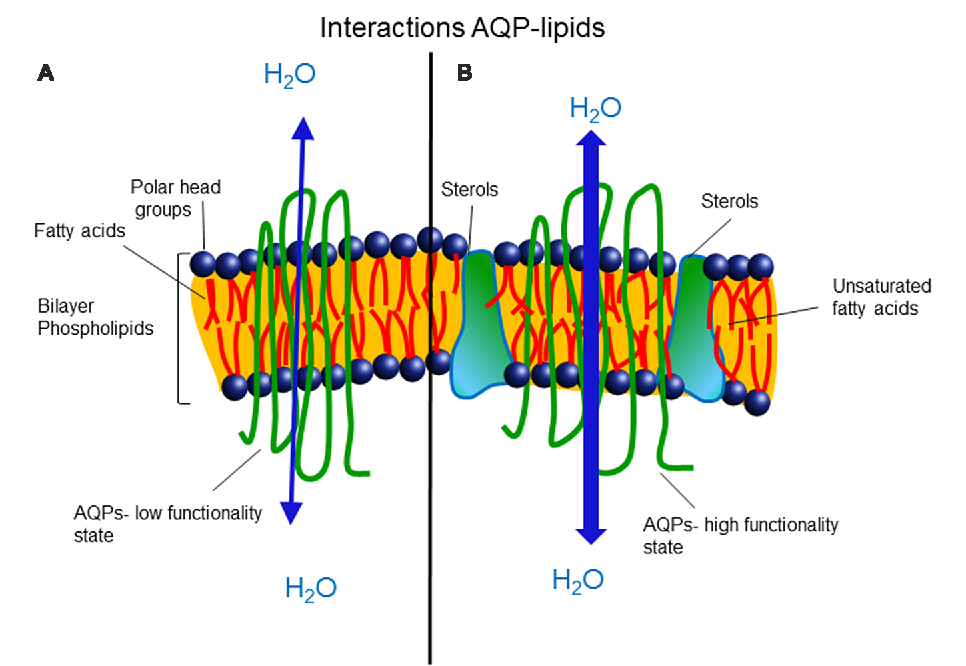 Чурилов; Кафедра патологии Медицинского факультета Санкт-Петербургского государственного университета (журнал «Медицина XXI век» № 5(6), 2007) [читать]
Чурилов; Кафедра патологии Медицинского факультета Санкт-Петербургского государственного университета (журнал «Медицина XXI век» № 5(6), 2007) [читать]
В отношении функциональной активности аквапоринов можно сделать следующие выводы (Шапигузов, 2004): [1] В присутствии аквапоринов скорость транспорта воды и некоторых других неэлектролитов через мембрану возрастает, а энергия активации этого процесса снижается. [2] Транспорт через аквапорины протекает с одинаковой скоростью в обоих направлениях при одинаковой разности химических потенциалов переносимого вещества по разные стороны мембраны. [3] Транспорт через аквапорины является пассивным. [4] Для аквапоринов характерна селективность. Транспорт незаряженной молекулы через пору мономера не сопровождается переносом ионов, в том числе и протонов. [5] Некоторые аквапорины ингибируются соединениями тяжелых металлов (Hg, Ag, Au, Cu, Ni).
Классификация аквапоринов основана на их специфичности по отношению к транспортируемым молекулам и аминокислотной последовательности.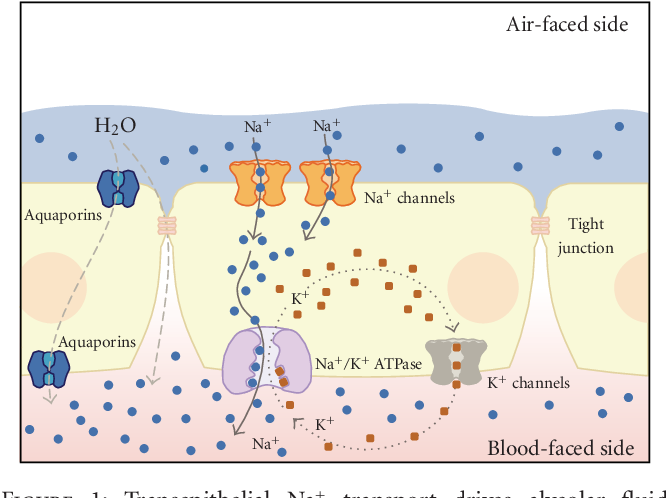 Первая группа включает собственно аквапорины специфичные по отношению к воде. К этой группе относятся следующие аквапорины млекопитающих AQP0, AQP1, AQP2, AQP4, AQP5, AQP6 и AQP8. Вторая группа включает акваглицеропорины. Различные представители этой группы в разной степени проницаемы для воды, но дополнительно проницаемы для других малых неэлектролитов, в первую очередь для глицерола и мочевины. К этой группе относятся 4 аквапорина млекопитающих (AQP3, AQP7, AQP9 и AQP10) (Титовец, 2007). Транспортные свойства AQP11 и AQP12 (супераквапоринов) к настоящему времени исследованы недостаточно. В головном мозге определяются AQP1,AQP3, AQP4, AQP9, AQP11.
Первая группа включает собственно аквапорины специфичные по отношению к воде. К этой группе относятся следующие аквапорины млекопитающих AQP0, AQP1, AQP2, AQP4, AQP5, AQP6 и AQP8. Вторая группа включает акваглицеропорины. Различные представители этой группы в разной степени проницаемы для воды, но дополнительно проницаемы для других малых неэлектролитов, в первую очередь для глицерола и мочевины. К этой группе относятся 4 аквапорина млекопитающих (AQP3, AQP7, AQP9 и AQP10) (Титовец, 2007). Транспортные свойства AQP11 и AQP12 (супераквапоринов) к настоящему времени исследованы недостаточно. В головном мозге определяются AQP1,AQP3, AQP4, AQP9, AQP11.
подробнее в статье «Роль аквапоринов в транспорте воды через биологические мембраны (обзор литературы)» А.В. Крысова, В.И. Циркин, А.А. Куншин; Вятский государственный гуманитарный университет; Казанский государственный медицинский университет (журнал «Вятский медицинский вестник» №2, 2012) [читать]
Нарушения экспрессии аквапоринов важны в этиологии и патогенезе большого числа патологических процессов.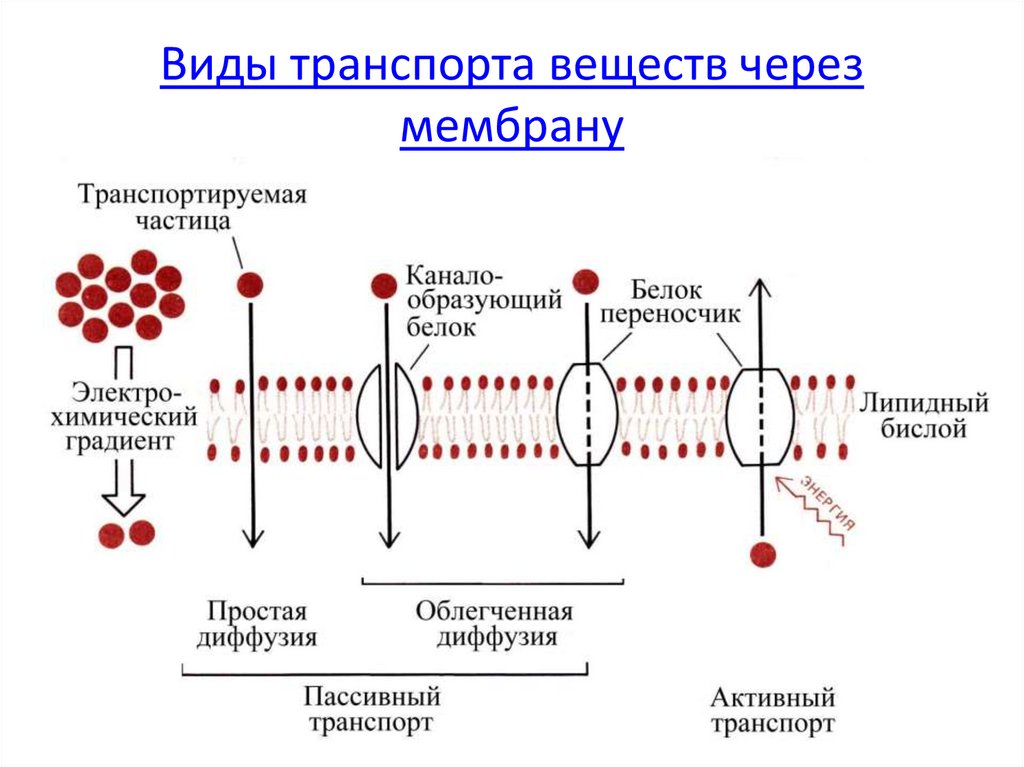 Дефект различных аквапоринов является причиной (этиологическим фактором) нарушения водного баланса мозга, некоторых случаев бронхиальной астмы, нарушения реабсорбции воды в кишечнике и почках, глаукомы, катаракты, нарушения продукции слюны, недостаточного потоотделения и так далее.
Дефект различных аквапоринов является причиной (этиологическим фактором) нарушения водного баланса мозга, некоторых случаев бронхиальной астмы, нарушения реабсорбции воды в кишечнике и почках, глаукомы, катаракты, нарушения продукции слюны, недостаточного потоотделения и так далее.
АКВАПОРИНЫ И ЦЕРЕБРАЛЬНЫЙ ОТЕК
За последнее десятилетие в области изучения патогенеза церебрального отека был достигнут значительный прогресс благодаря открытию аквапоринов и выяснению их роли в водном обмене структур головного мозга в норме и при патологии. Ранее при описании механизмов отека головного мозга речь шла, в общем, о накоплении воды вследствие нарушения проницаемости гематоэнцефалического барьера, деструкции клеточных мембран и т. д., при этом не было представления о конкретных молекулярных механизмах нарушения водного обмена. Согласно новому фундаментальному знанию, водный обмен головного мозга осуществляется при непосредственном участии аквапоринов AQP1, AQP4 и AQP9. Эти водные каналы поддерживают водный гомеостаз, пространственно организуют и обеспечивают облегченный транспорт воды между основными водными компартментами головного мозга: [1] водой крови и жидкостью паренхимы головного мозга; [2] внутриклеточной и внеклеточной жидкостью; [3] цереброспинальной жидкостью (ЦСЖ) желудочков и водой субарахноидального пространства.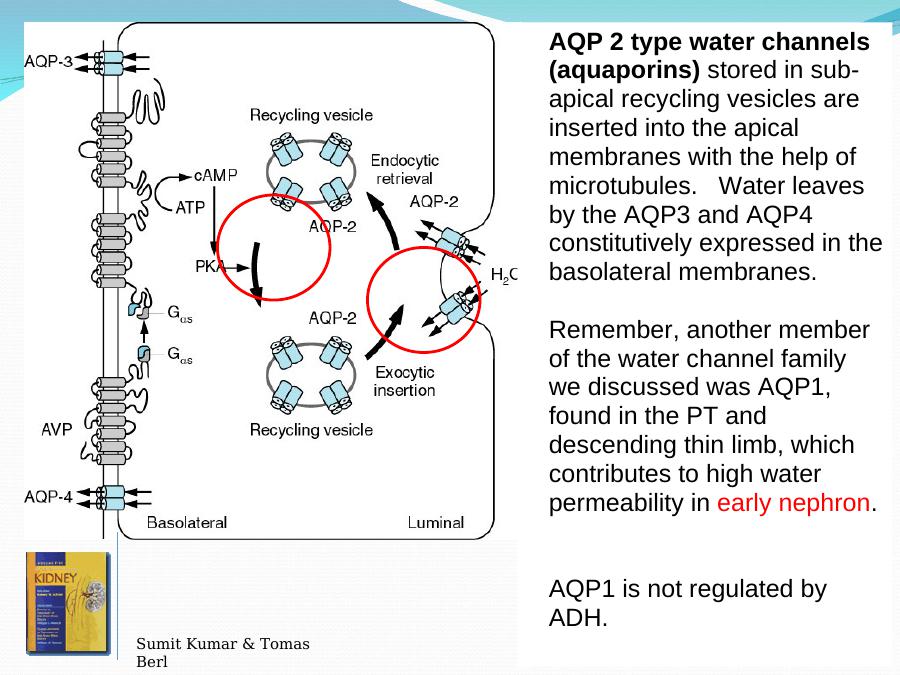 Основная нагрузка при этом ложится на аквапорины AQP1 и AQP4, однако их функциональная роль в физиологических и патологических условиях различна. Все аквапорины свободно переносят воду как в прямом, так и в обратном направлении в зависимости от направления вектора осмотического или гидростатического давления. От уровня их экспрессии в плазматической мембране клетки, а также от уровня их активности зависит величина водного потока. В отличие от AQP4 аквапорины AQP1 и AQP9 являются переносчиками не только воды, но и газов, а также других важных биорегуляторов и метаболитов.
Основная нагрузка при этом ложится на аквапорины AQP1 и AQP4, однако их функциональная роль в физиологических и патологических условиях различна. Все аквапорины свободно переносят воду как в прямом, так и в обратном направлении в зависимости от направления вектора осмотического или гидростатического давления. От уровня их экспрессии в плазматической мембране клетки, а также от уровня их активности зависит величина водного потока. В отличие от AQP4 аквапорины AQP1 и AQP9 являются переносчиками не только воды, но и газов, а также других важных биорегуляторов и метаболитов.
AQP1 представляет собой количественно преобладающий водный канал эпителия хориоидального сплетения. Здесь он экспрессируется в апикальной мембране клеток хориоидального сплетения и играет главную роль в продуцировании ЦСЖ. Считается, что в норме в остальной части головного мозга AQP1 отсутствует или его экспрессия невысока. Вместе с тем биохимические и гистохимические исследования по идентификации AQP1 на секционном материале нормального мозга человека позволили обнаружить относительно небольшое количество AQP1 примерно в 33% микрососудов головного мозга. Интересно отметить, что в эндотелии кровеносных сосудов вне головного мозга AQP1 экспрессируется в большом количестве и определяет интенсивность гистогематического обмена воды. В целом вопрос об уровне его экспрессии в клетках эндотелия микрососудов головного мозга остается открытым. По-видимому, наличие неоднозначных данных о распределении AQP1 в тканях головного мозга связано с тем, что многие патологические состояния, начиная с гипоксии, сопровождаются активацией экспрессии этого канала в эндотелии микрососудов. Так, аквапорин AQP1 экспрессируется в большом количестве в эндотелии микрососудов астроцитомы человека и митостатических карциномах. Он обнаруживается также в эндотелии микрососудов глиобластом. Экспрессия AQP1 возрастает при опухолях хориоидального сплетения, что сопровождается повышением продуцирования ЦСЖ.
Интересно отметить, что в эндотелии кровеносных сосудов вне головного мозга AQP1 экспрессируется в большом количестве и определяет интенсивность гистогематического обмена воды. В целом вопрос об уровне его экспрессии в клетках эндотелия микрососудов головного мозга остается открытым. По-видимому, наличие неоднозначных данных о распределении AQP1 в тканях головного мозга связано с тем, что многие патологические состояния, начиная с гипоксии, сопровождаются активацией экспрессии этого канала в эндотелии микрососудов. Так, аквапорин AQP1 экспрессируется в большом количестве в эндотелии микрососудов астроцитомы человека и митостатических карциномах. Он обнаруживается также в эндотелии микрососудов глиобластом. Экспрессия AQP1 возрастает при опухолях хориоидального сплетения, что сопровождается повышением продуцирования ЦСЖ.
AQP4 является самым активным водным каналом. В центральной нервной системе он обнаруживается в астроцитах всех отделов головного и спинного мозга и клетках эпендимы, выстилающей желудочки. Его экспрессия избирательна, вследствие чего AQP4 локализуется лишь в определенных субклеточных структурах. В астроцитах, где отмечается высокополяризованное субклеточное распределение AQP4, он сосредоточен в оконечных ножках астроцитов и базолатеральных областях плазматической мембраны ограничивающей глии, т. е. на поверхностях разделов кровь-паренхима или ЦСЖ-паренхима головного мозга. Обычно этот аквапорин организован в так называемые ортогональные структуры. Концевые отростки ножек астроцитов, где сосредоточен AQP4, находятся в тесном контакте с мозговыми микрососудам, а также с синапсами. Именно AQP4 в концевых отростках астроглиальных клеток определяет проницаемость к воде гематоэнцефалического барьера.
Его экспрессия избирательна, вследствие чего AQP4 локализуется лишь в определенных субклеточных структурах. В астроцитах, где отмечается высокополяризованное субклеточное распределение AQP4, он сосредоточен в оконечных ножках астроцитов и базолатеральных областях плазматической мембраны ограничивающей глии, т. е. на поверхностях разделов кровь-паренхима или ЦСЖ-паренхима головного мозга. Обычно этот аквапорин организован в так называемые ортогональные структуры. Концевые отростки ножек астроцитов, где сосредоточен AQP4, находятся в тесном контакте с мозговыми микрососудам, а также с синапсами. Именно AQP4 в концевых отростках астроглиальных клеток определяет проницаемость к воде гематоэнцефалического барьера.
читайте также пост: Нейроваскулярная единица (на laesus-de-liro.livejournal.com) [читать]
AQP4 обеспечивает быстрое локальное перемещение воды из периваскулярного пространства (вследствие увеличения уровня экспрессии AQP4), что лежит в основе механизма контроля как собственно объема периваскулярного пространства, так и регуляции скорости церебральной перфузии (например, при астроцитоме уровни экспрессии AQP4 в перитуморозной области, по данным магнитнорезонансной томографии [МРТ], коррелируют с зоной распространения отека).
 Наличие коррелятивных взаимоотношений между экспрессией AQP4 и выраженностью отека установлено также при ишемии, травме головного мозга и субарахноидальных кровоизлияниях. Важная роль AQP4 в патогенезе церебрального отека была экспериментально обоснована и однозначно доказана многочисленными исследованиями. При этом AQP4 выполняет бимодальную функцию в патогенезе церебрального отека, и его конкретная роль зависит от того, какой отек преобладает – вазогенный или цитотоксический. При вазогенном отеке процесс реабсорбции жидкости может быть ускорен путем повышения уровня экспрессии AQP4, а развитие цитотоксического отека на ранних стадиях ишемии может быть предотвращено путем понижения активности этого аквапорина.
Наличие коррелятивных взаимоотношений между экспрессией AQP4 и выраженностью отека установлено также при ишемии, травме головного мозга и субарахноидальных кровоизлияниях. Важная роль AQP4 в патогенезе церебрального отека была экспериментально обоснована и однозначно доказана многочисленными исследованиями. При этом AQP4 выполняет бимодальную функцию в патогенезе церебрального отека, и его конкретная роль зависит от того, какой отек преобладает – вазогенный или цитотоксический. При вазогенном отеке процесс реабсорбции жидкости может быть ускорен путем повышения уровня экспрессии AQP4, а развитие цитотоксического отека на ранних стадиях ишемии может быть предотвращено путем понижения активности этого аквапорина.Обратите внимание! Следует помнить о том, что высокоспецифические аутоантитела к AQP4 (NMO-IgG) вызывают демиелинизирующие поражения ЦНС, при которых клинически наблюдается преимущественное поражение зрительных нервов и/или спинного мозга («спектр оптикомиелит-ассоциированных расстройств» – neuromyelitis optica spectrum disorders, или NMOSD).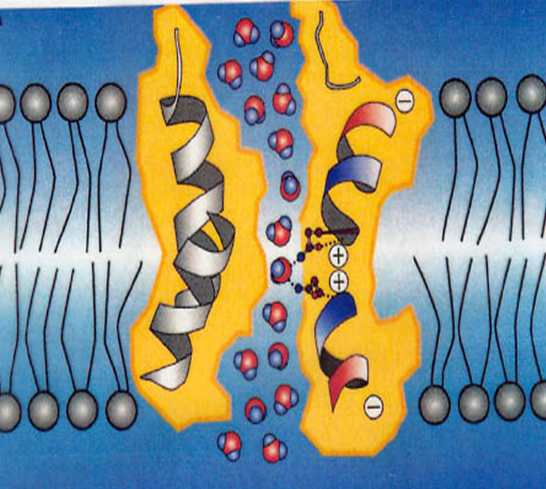 Также AQP4 учавствует в функционировании глимфатической система головного мозга.
Также AQP4 учавствует в функционировании глимфатической система головного мозга.
Читайте также:
пост «Спектр оптикомиелит-ассоциированных расстройств» (на laesus-de-liro.livejournal.com) [читать];
статью «Глимфатическая система головного мозга: функциональная анатомия и клинические перспек-тивы» Николенко В.Н., Оганесян М.В., Яхно Н.Н., Орлов Е.А., Порубаева Э.Э., Попова Е.Ю.; ФГАОУ ВО «Первый Московский государственный медицинский университет имени И.М. Сеченова» МЗ РФ, Москва; ФГБОУ ВО «Московский государственный университет имени М.В. Ломоносова», Москва (журнал «Неврология, нейропсихиатрия, психосоматика» №4, 2018) [читать]
Роль AQP9, который экспрессируется в астроцитах и катехоламинэргических нейронах, не ограничивается только функцией транспорта воды. Этот аквапорин принимает участие в энергетическом обмене головного мозга, обеспечивая перенос лактата, глицерина и других энергетических субстратов. Следует отметить, что экспрессия AQP9 зависит от концентрации инсулина.
 При ишемии уровень экспрессии этого аквапорина повышается, и имеются указания на то, что AQP9 может принимать участие в утилизации лактата, накапливающегося при ишемии головного мозга. В отличие от AQP4, AQP9 не отводится основная роль в патогенезе отека.
При ишемии уровень экспрессии этого аквапорина повышается, и имеются указания на то, что AQP9 может принимать участие в утилизации лактата, накапливающегося при ишемии головного мозга. В отличие от AQP4, AQP9 не отводится основная роль в патогенезе отека.Подробнее об аквапоринах и церебральном отеке в следующих источниках:
статья «Церебральный отек и современные направления его лечения» Э.П. Титовец, А.Ф. Смеянович; Республиканский научно-практический центр неврологии и нейрохирургии, Минск, Беларусь (журнал «Вестник национальной академии наук Белоруссии» №1, 2011) [читать];
статья «Клиническая патофизиология отека головного мозга (часть 1)» А.А. Задворнов, А.В. Голомидов, Е.В. Григорьев; ГАУЗ КО «Областная детская клиническая больница», г. Кемерово; ФГБУ «НИИ комплексных проблем сердечно-сосудистых заболеваний», г. Кемерово (журнал «Вестник анестезиологии и реаниматологии» №3, 2017) [читать];
статья «Клиническая патофизиология отека головного мозга (часть 2)» А. А. Задворнов, А.В. Голомидов, Е.В. Григорьев; ГАУЗ КО «Областная детская клиническая больница», г. Кемерово; ФГБУ «НИИ комплексных проблем сердечно-сосудистых заболеваний», г. Кемерово (журнал «Вестник анестезиологии и реаниматологии» №4, 2017) [читать];
А. Задворнов, А.В. Голомидов, Е.В. Григорьев; ГАУЗ КО «Областная детская клиническая больница», г. Кемерово; ФГБУ «НИИ комплексных проблем сердечно-сосудистых заболеваний», г. Кемерово (журнал «Вестник анестезиологии и реаниматологии» №4, 2017) [читать];
[для подписчиков журнала «Вестник национальной академии наук Белоруссии»] статья «Коррекция нарушений церебрального водного обмена» Э.П. Титовец, А.Ф. Смеянович, П.В. Козич; Республиканский научно-практический центр неврологии и нейрохирургии, Минск, Беларусь (журнал «Вестник национальной академии наук Белоруссии» №1, 2019) [перейти]
© Laesus De Liro
Атлас контактов
Информация о белок-белковых контактах
Субъединицы белка не связаны между собой ковалентно.
Однако в нем присутствуют немногочисленные солевые мостики (разновидность ионной связи между COO– и Nh4+ группами). Основной вклад в поддержание тетрамерной структуры вносят гидрофобные карманы и стекинг-взаимодействия.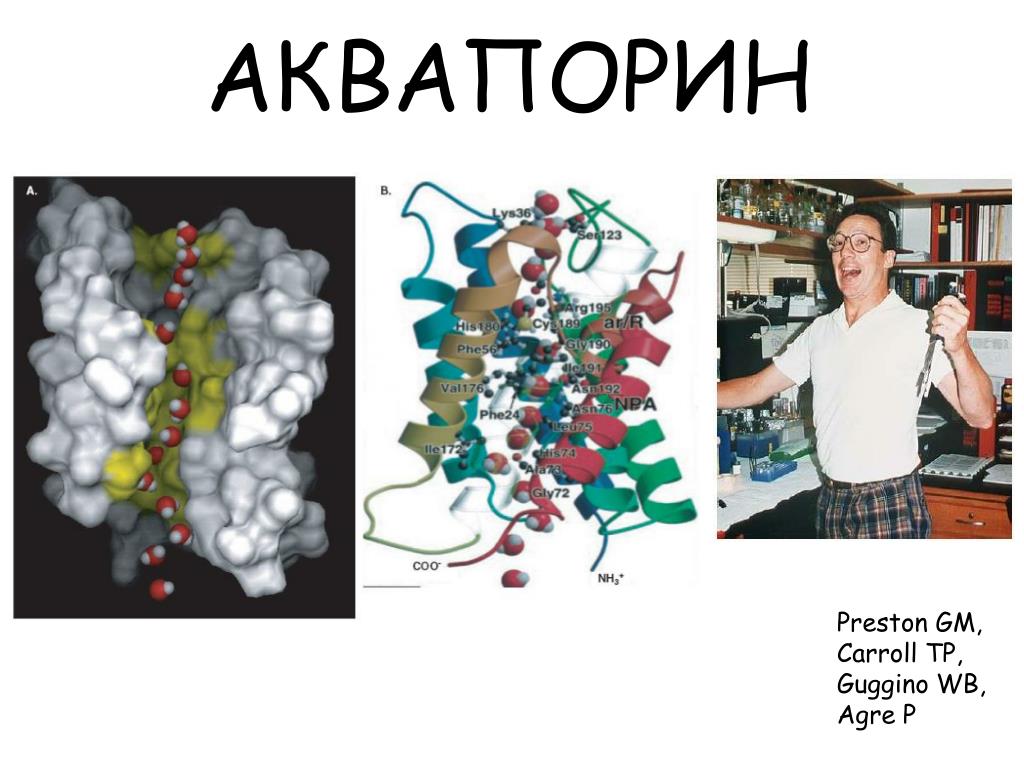 Эти скрипты можно посмотреть в апплете ниже. Кстати, с помощью особых скриптов, мы посчитали, сколько есть разных вариантов стекинг-взаимодействий:
Phe-Phe – 27, His-Phe – 7, His-His – 0, Tyr-Phe – 8, Tyr-His – 0, Tyr-Tyr – 5, Trp-Phe – 12, Trp-His – 5, Trp-Tyr – 12, Trp-Trp – 3. Гидрофобные карманы искали при помощи Clud.
Водородные связи также вносят вклад в объединение субъединиц, но поскольку технические возможности JMol не позволяют автоматически их найти, мы показали как минимум одну вручную.
Координаты атомов на рисунке:
Эти скрипты можно посмотреть в апплете ниже. Кстати, с помощью особых скриптов, мы посчитали, сколько есть разных вариантов стекинг-взаимодействий:
Phe-Phe – 27, His-Phe – 7, His-His – 0, Tyr-Phe – 8, Tyr-His – 0, Tyr-Tyr – 5, Trp-Phe – 12, Trp-His – 5, Trp-Tyr – 12, Trp-Trp – 3. Гидрофобные карманы искали при помощи Clud.
Водородные связи также вносят вклад в объединение субъединиц, но поскольку технические возможности JMol не позволяют автоматически их найти, мы показали как минимум одну вручную.
Координаты атомов на рисунке:
Белый [ILE]15:A.H/3 #57 48.115 37.977 41.335
Синий [ILE]15:A.N/3 #49 47.869 37.642 40.583
Это можно считать водородной связью, поскольку расстояние между атомами меньше 3 ангстрем (0,2нм = 2Å), а угол близок к 180°. Рис. 2. Водородная связь между субъединицами
Плотность упаковки атомов в гидрофобном ядре
Мы взяли для рассмотрения ядро у Phe58, взятого в качестве MyResidue. В окружении этого аминокислотного остатка в основном присутствуют остатки лейцина, аланина и фенилаланина.
Атомы на расстоянии 1 Å от остатка MyResidue отсутствуют и присутствуют, начиная с 2 Å. C 7 Å атомы Phe58 уже практически полностью закрыты.
Для вычисления характерного расстояния между соседними не связанными ковалентно атомами в гидрофобном ядре было посчитано среднее значение длины среди 28 связей. Среднее расстояние равно 2,78 Å.
Для того, чтобы выяснить, сможет ли поместиться между соседними атомами ядра еще один, было высчитано среднее расстояние между границами Ван-дер-Ваальсовых радиусов.
Данная величина равна 0,63 Å, что говорит о том, что, например, молекула воды, которая имеет радиус в районе 1,4 Å, маловероятно сможет поместится между атомами гидрофобного ядра. [6] Но стоит заметить, что существует несколько пар атомов, например, углерод из Gly95 и углерод из Leu57, которые имеют большее расстояние между друг другом, чем Ван-дер-Ваальсов радиус воды (1,53 Å).
Из этого можно сделать вывод, что в некоторых местах молекула воды может попасть в гидрофобное ядро.
Previous Next
Информация о лиганд-белковых контаках
BOG
Отметим, что это молекулы растворителя, которыми удалось извлечь белок из мембраны, а не простетическая часть реального белка. Тем не менее, мы изучили, как он с ним связывается. Ионных, ковалентных взаимодействий и солевых мостиков ожидать не приходится. Но вот своим углеводородным хвостом он связывается с фенилаланином, то есть с помощью “гидрофобных” взаимодействий. Также BOG образует водородные связи с белком (см. скрипт).
Хлорид-ион
Функция хлорид-иона в аквапорине остается неясной. Более того, большая часть аквапоринов не пропускает их через себя, зато пропускает человеческий AQP6 [7].
Один хлорид-ион находится прямо в канале и “закупоривает” отверстие.
Возможно, именно из-за того, что он там застрял, мембрана с аквапорином обладает свойством избирательной проницаемости.
Удерживается он в канале несколькими аргининами сверху, которые несут положительный заряд и несколькими триптофанами снизу.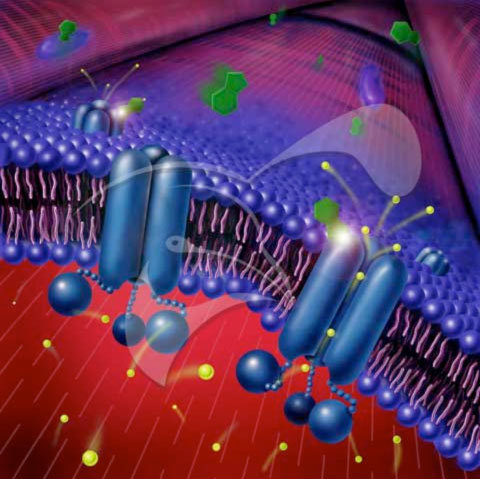 Есть основания полагать, что аргинины там и нужны, чтобы задерживать отрицательно-заряженные ионы.
Остальные хлорид-ионы держатся засчет δ+ заряда NH группы пептидной связи. Все скрипты можно найти ниже в апплете.
Есть основания полагать, что аргинины там и нужны, чтобы задерживать отрицательно-заряженные ионы.
Остальные хлорид-ионы держатся засчет δ+ заряда NH группы пептидной связи. Все скрипты можно найти ниже в апплете.
JMol апплет
Ссылки на пояснительные скрипты
1. Почему водородных связей между субъединицами нет
2. Почему нет ковалентных связей между субъединицами
3. Солевые мостики
4. Стекинг-взаимодействия
5. Какие есть стекинг-взаимодействия
6. Гидрофобные взаимодействия между мономерами
7. Гидрофобное ядро
8. Как связан BOG
9. Как связаны хлорид-ионы
Информация о положении в мембране
Чтобы предсказать по первичной последовательности, какие участки белка погружены в мембрану, а какие нет, мы воспользовались сервисом Transmembrane protein topology prediction with a hidden Markov model. В результате работы сервиса TMHMM, мы получили следующие данные:
Рис. 3. TMHMM-таблица Рис. 4. Предсказание трансмембранных участков.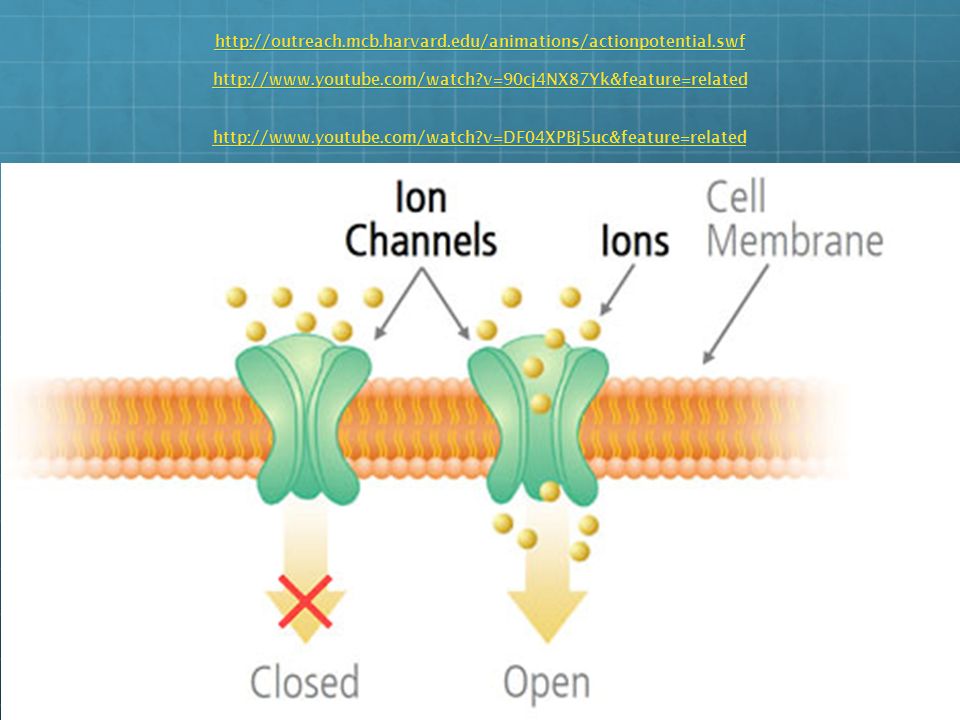 TMhelix – трансмембранная часть белка, inside – часть белка во внутренней части клетки, outside – часть белка снаружи от мембраны.
TMhelix – трансмембранная часть белка, inside – часть белка во внутренней части клетки, outside – часть белка снаружи от мембраны.На оси Y отображены соответсвующие вероятности, а на оси Х – номер аминокислотного остатка белка. Красным цветом показаны предполагаемые трансмембранные части, розовым – части, обращеннные наружу, синим – части, обращенные внутрь.
Было предсказано 6 трансмембранных частей, 3 находящихся снаружи и 4 внутри, что соответствует действительности. Хотя можно заметить, что координаты участков отличаются в среднем на 4-5а.о., предсказание выполнено довольно точно.
Визуализация расположения белка в мембране
Для представления расположения аквапорина в мембране мы взяли существующую модель из банка PDB
Заключение
Для изучения был взят аквапорин Aqy1 Pichia Pastoris. В ходе исследования данного белка было выяснено, что он является тетрамером, т.е. состоит из 4 субъединиц-мономеров.
Также аквапорин имеет 2 низкомолекулярных лиганда (хлорид-ион и β-D-октил-глюкозид, которого находится по 3 в каждом мономере). Были изучены связи между ними.
Еще наша команда изучила гидрофобное ядро, и в ходе исследования были сделаны некоторые выводы по его плотности упаковки.
В ходе работы были также сделаны предсказания о положении белка в мембране, которые в дальнейшем оказались соответствующими действительности.
Были изучены связи между ними.
Еще наша команда изучила гидрофобное ядро, и в ходе исследования были сделаны некоторые выводы по его плотности упаковки.
В ходе работы были также сделаны предсказания о положении белка в мембране, которые в дальнейшем оказались соответствующими действительности.
Личный вклад
Владимиров Даниил исследовал белок-белковые взаимодействия, подготовил видеоролик и иллюстрации.
Петрухин Егор занимался изучением гидрофобного ядра, разработал соответствующие скрипты и иллюстрации.
Носкова Елизавета анализировала положение аквапорина в мембране, BOG- и белок-белковые взаимодействия, написала скрипты для этого.
Никитин Павел оформил отчёт и разместил его на своем сайте, а также изучал особенности хлорид-белковых взаимодействий.
Ссылки на источники
[1] Bonhivers M. et al. Aquaporins in Saccharomyces genetic and functional distinctions between laboratory and wild-type strains
//Journal of Biological Chemistry. – 1998.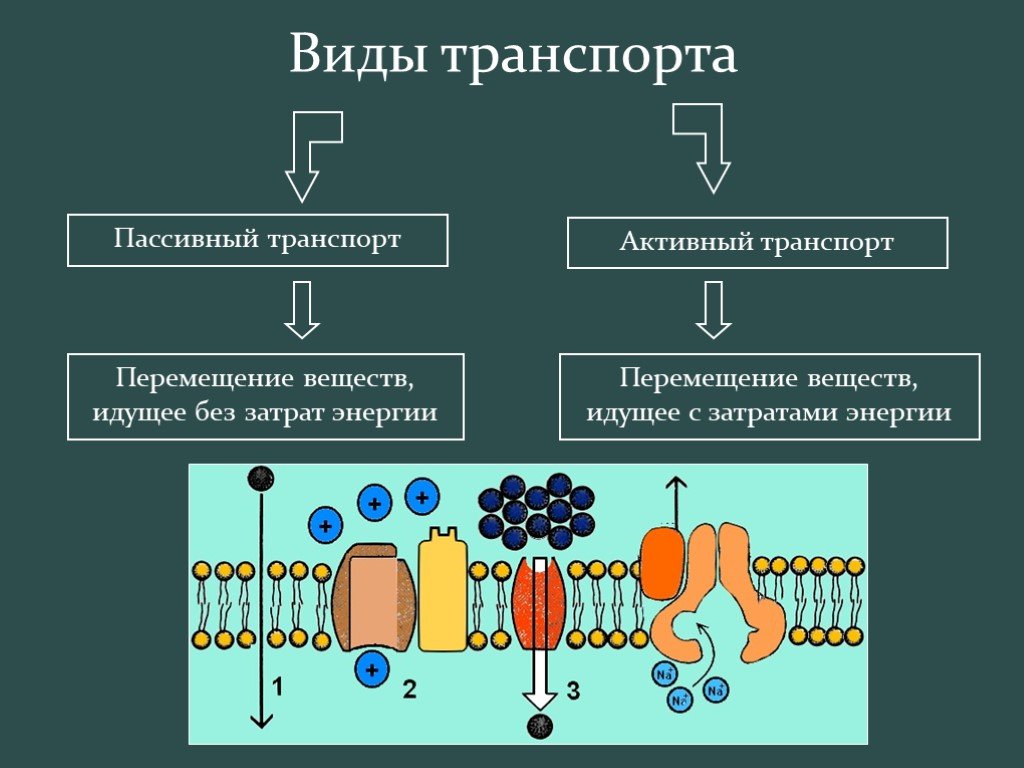 – Т. 273. – №. 42. – С. 27565-27572. doi: 10.1074/jbc.273.42.27565
– Т. 273. – №. 42. – С. 27565-27572. doi: 10.1074/jbc.273.42.27565
[2] Sidoux-Walter F., Pettersson N., Hohmann S. The Saccharomyces cerevisiae aquaporin Aqy1 is involved in sporulation //Proceedings of the National Academy of Sciences. – 2004. – Т. 101. – №. 50. – С. 17422-17427. doi: 10.1073/pnas.0404337101
[3] yeastgeonome.org (AQY1 / YPR192W Regulation)
[4] PDB in Europe
[5] Uniprot Aqy1 homologus
[6]. Дж. Эмсли. Элементы. 1993г
[7] Abir-Awan M. et al. Inhibitors of mammalian aquaporin water channels //International journal of molecular sciences. – 2019. – Т. 20. – №. 7. – С. 1589. doi: 10.3390/ijms20071589
Аквапорины – ПМС
- Список журналов
- Рукописи авторов HHS
- PMC3590904
Карр Биол. Авторская рукопись; доступно в PMC 2014 21 января.
Авторская рукопись; доступно в PMC 2014 21 января.
Опубликовано в окончательной редакции как:
Curr Biol. 2013 21 января; 23(2): Р52–Р55.
DOI: 10.1016/j.cub.2012.11.025
PMCID: PMC3590904
NIHMSID: NIHMS448095
PMID: 23347934
Copyright Copyright и лицензионная информация. небольших интегральных мембранных белков, которые широко экспрессируются во всех царствах животных и растений. Они имеют схожую базовую структуру с мономерами аквапоринов, состоящими из шести трансмембранных спиральных сегментов и двух коротких спиральных сегментов, которые окружают цитоплазматические и внеклеточные вестибюли, соединенные узкой водной порой. Они содержат несколько консервативных мотивов, включая последовательности NPA в своих коротких спиральных сегментах. Мономеры аквапорина собираются в виде тетрамеров в мембранах, причем каждый мономер функционирует независимо. Некоторые аквапорины, такие как AQP4 млекопитающих, могут дополнительно агрегировать в клеточных мембранах с образованием надмолекулярных кристаллических ансамблей, называемых ортогональными массивами частиц.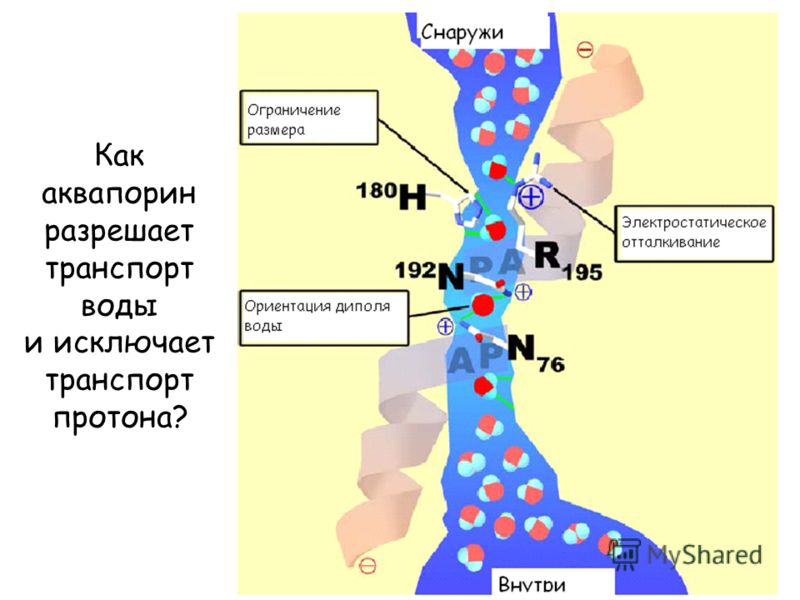
Открыть в отдельном окне
Структура и клеточные функции аквапоринов
(A) Мембранная топография мономера аквапорина (слева) и кристаллическая структура (AQP1, PDB 1j4n) (вид сбоку слева; вид сверху справа ) с четырьмя молекулами воды (красные шарики), показанными в водной области пор. Спирали помечены как h2–H8. (B) Секреция эпителиальной жидкости. Высокая трансэпителиальная водопроницаемость способствует активной почти изоосмолярной секреции жидкости экзокринными железами. (C) Миграция клеток. Миграция клеток, облегчаемая AQP, включает проникновение воды в выступающие ламеллоподии в мигрирующих клетках. (D) Увлажнение кожи. AQP3 поддерживает высокий уровень глицерина в роговом слое; глицерин действует как увлажнитель, удерживая воду. (E) Метаболизм адипоцитов. AQP7 способствует выходу глицерина из адипоцитов, предотвращая накопление внутриклеточного глицерина и триглицеридов. AQP, аквапорин; ТГ, триглицерид; СЖК, свободная жирная кислота.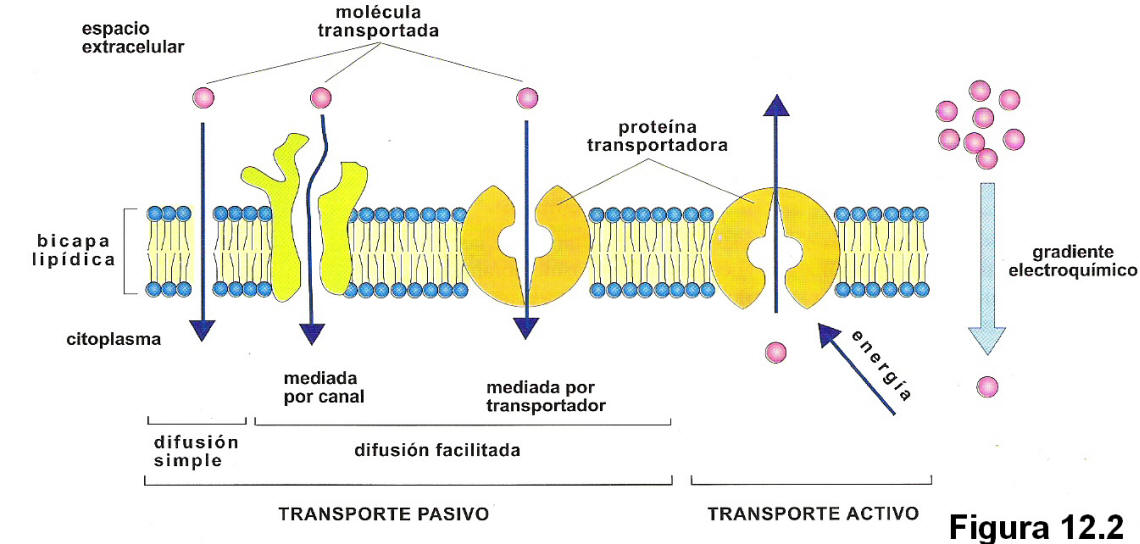
Основной функцией большинства аквапоринов является транспорт воды через клеточные мембраны в ответ на осмотические градиенты, создаваемые активным транспортом растворенных веществ. Поскольку водотранспортная способность мономеров аквапоринов низка, мембраны часто содержат аквапорины с высокой плотностью, до 10 000 на квадратный микрон, что значительно повышает водопроницаемость по сравнению с отсутствием аквапоринов. Моделирование молекулярной динамики предполагает, что стерические факторы и электростатические взаимодействия в водной поре ответственны за селективность аквапоринов по отношению к воде. Подгруппа аквапоринов, называемая акваглицеропоринами, также переносит глицерин. Диаметр пор акваглицеропоринов немного больше, чем у водоселективных аквапоринов, и поры выстланы относительно гидрофобными остатками по сравнению с порами водоселективных аквапоринов.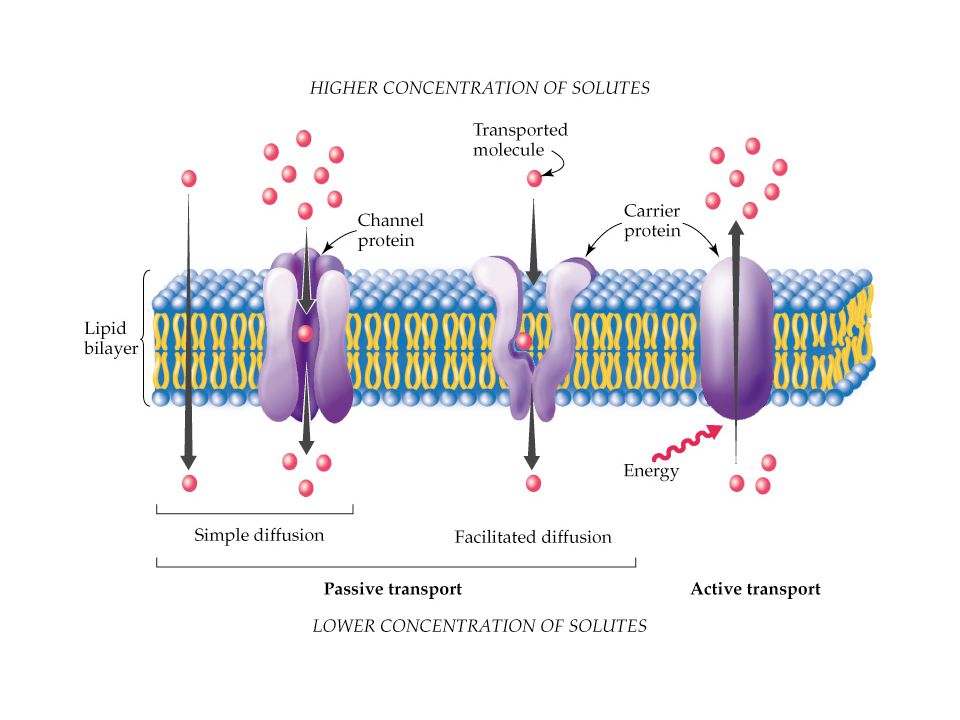
Большинство клеток не экспрессируют аквапорины. Практически все биологические мембраны в достаточной степени проницаемы для воды вследствие диффузии воды через мембранные липиды, так что объем клетки уравновешивается за несколько минут или меньше в ответ на осмотический градиент. Так зачем же тогда в некоторых клетках нужна высокая водопроницаемость мембраны? Одним из примеров является секреция и абсорбция жидкости через слои эпителиальных клеток, например, в почечных канальцах и экзокринных железах, где нормальная функция почек и секреция телесных жидкостей, таких как слюна, требуют высокой трансэпителиальной проницаемости для воды, облегчаемой аквапорином. Высокая водопроницаемость также облегчает движение воды через барьеры между жидкостью и тканями, например, между кровью и паренхимой головного мозга через гематоэнцефалический барьер. Другие клеточные и тканевые функции водного транспорта аквапоринов и транспорта глицерина, облегчаемого акваглицеропорином, не очевидны априори .
Высокая водопроницаемость также облегчает движение воды через барьеры между жидкостью и тканями, например, между кровью и паренхимой головного мозга через гематоэнцефалический барьер. Другие клеточные и тканевые функции водного транспорта аквапоринов и транспорта глицерина, облегчаемого акваглицеропорином, не очевидны априори .
Аквапорины млекопитающих, которых насчитывается около дюжины, экспрессируются во многих типах клеток, участвующих в транспорте жидкости, включая эпителий и эндотелий в почках, легких, экзокринных железах, глазах и органах желудочно-кишечного тракта. Однако аквапорины также экспрессируются в клетках, не играющих очевидной роли в транспорте жидкости, таких как эритроциты и некоторые лейкоциты, адипоциты и скелетные мышцы. Аквапорины также экспрессируются в астроцитах по всей центральной нервной системе и в поддерживающих клетках (но не в электрически возбудимых клетках) в органах чувств, таких как клетки Мюллера сетчатки. В глазу аквапорины экспрессируются в роговице, хрусталике и цилиарном эпителии.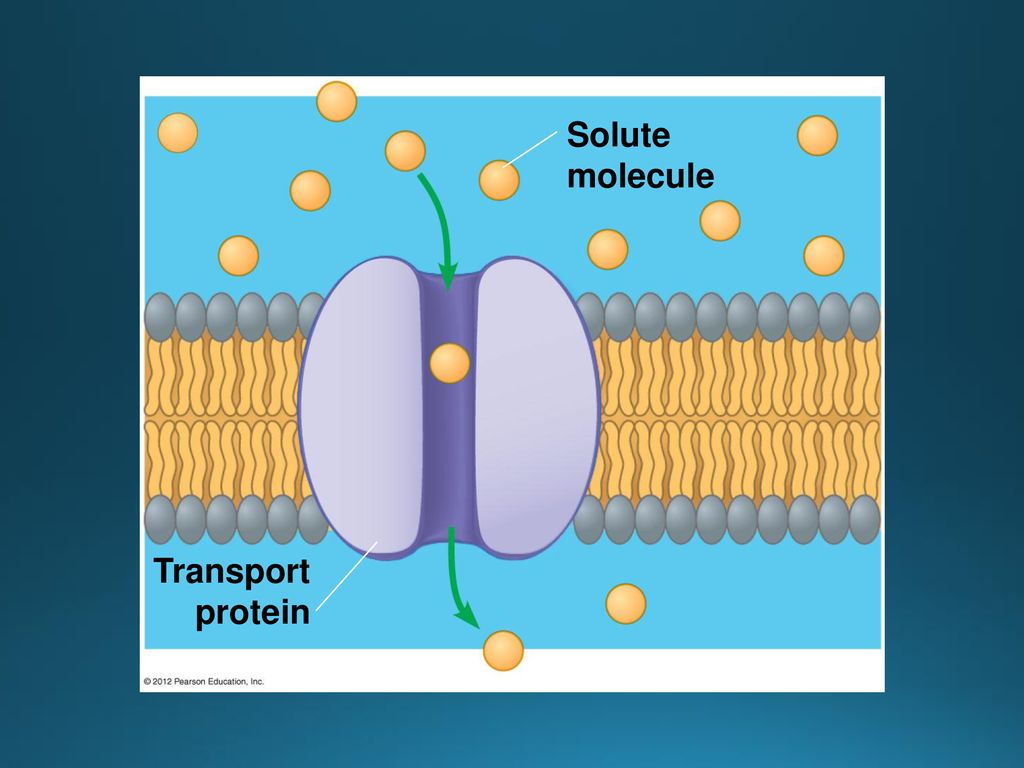 Распределение аквапоринов в тканях млекопитающих дало первоначальные сведения об их клеточных и органных функциях, хотя многие из первоначальных догадок не были подтверждены в исследованиях фенотипов на мышах с нокаутом по аквапоринам.
Распределение аквапоринов в тканях млекопитающих дало первоначальные сведения об их клеточных и органных функциях, хотя многие из первоначальных догадок не были подтверждены в исследованиях фенотипов на мышах с нокаутом по аквапоринам.
Аквапорины экспрессируются в различных растениях и микробах, включая бактерии и дрожжи. Было идентифицировано большое количество аквапоринов растений, названных PIP (внутренние белки плазматической мембраны) и TIP (внутренние белки тонопласта) из-за особенностей их клеточной экспрессии. Исследования делеции выявили множество интересных ролей аквапоринов в растениях, включая транспирацию, метаболизм и репродукцию, которые важны для адаптации растений к различным стрессам окружающей среды. Хотя аквапорины также экспрессируются у некоторых микробов, исследования делеций не выявили какого-либо четкого фенотипа, хотя есть наводящие доказательства того, что аквапорины могут быть защитными при стрессе замораживания-оттаивания, возможно, для поддержания водопроницаемости клеточных мембран при низкой температуре. Высокое отношение поверхности к объему микробов предсказывает быстрое осмотическое уравновешивание, что делает аквапорины ненужными для большинства функций, таких как осморегуляция.
Высокое отношение поверхности к объему микробов предсказывает быстрое осмотическое уравновешивание, что делает аквапорины ненужными для большинства функций, таких как осморегуляция.
Фенотипический анализ мышей с нокаутом по аквапорину подтвердил ожидаемую роль аквапоринов в трансэпителиальном транспорте жидкости (). Удаление различных аквапоринов в почечных канальцах вызывает избыточный диурез и нарушение концентрационной способности мочи. Высокая водопроницаемость, зависящая от аквапоринов, необходима в проксимальных канальцах почек для почти изоосмолярной абсорбции жидкости, в тонком нисходящем колене Генле для противотока и в собирательных трубочках для абсорбции воды. Аквапорины также способствуют секреции эпителиальной жидкости в слюнных и подслизистых железах дыхательных путей, а также в сосудистом сплетении (из которого секретируется спинномозговая жидкость) и цилиарном эпителии (из которого секретируется глазная жидкость). Однако есть важное предостережение: аквапорины необходимы для трансэпителиального транспорта жидкости, когда скорость транспорта жидкости (на площадь эпителиальной поверхности) очень высока, как в проксимальных канальцах и слюнных железах.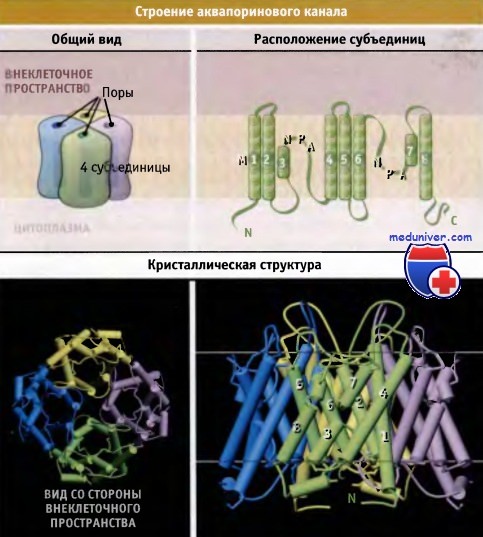 Хотя аквапорины экспрессируются и функционируют в эпителии легких, кишечника и потовых желез, они, по-видимому, не играют значительной физиологической роли.
Хотя аквапорины экспрессируются и функционируют в эпителии легких, кишечника и потовых желез, они, по-видимому, не играют значительной физиологической роли.
Непредвиденная роль аквапоринов заключается в миграции клеток. Делеция AQP1 у мышей нарушает ангиогенез как следствие снижения скорости миграции эндотелиальных клеток микрососудов. Аквапорин-зависимая миграция была обнаружена в самых разных типах клеток. Биофизические исследования предполагают, что поляризация аквапоринов к переднему краю мигрирующих клеток облегчает приток воды во время ламеллоподиального растяжения (4). В отличие от трансэпителиального транспорта жидкости, где аквапорины облегчают движение воды через клеточные слои, аквапорины в мигрирующих клетках облегчают локальный транзиторный транспорт воды. Другая непредвиденная роль аквапорина заключается в нейровозбуждении: делеция AQP4 ухудшает нейросенсорную передачу сигналов и изменяет динамику судорог и распространяющейся в коре депрессии. Хотя этот механизм до конца не выяснен, похоже, что транспорт воды, облегчаемый AQP4, необходим для быстрых изменений объема внеклеточного пространства и K + , и что потеря AQP4 приводит к замедленному обратному захвату K + после нейровозбуждения.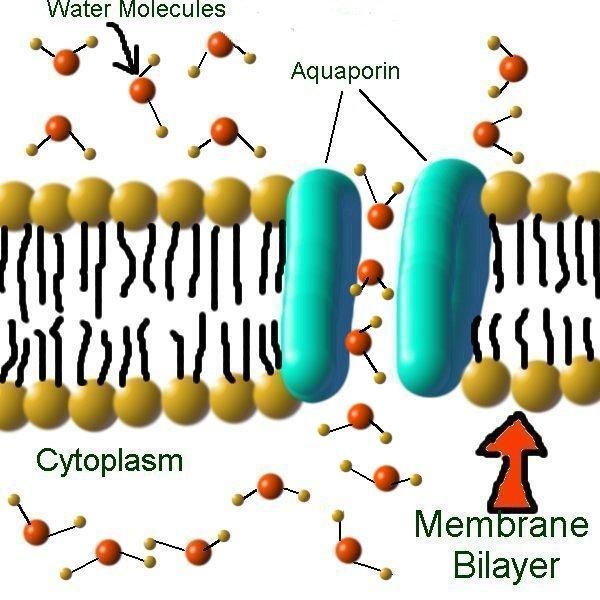 Другие неожиданные роли водоселективных аквапоринов включают их участие в прозрачности роговицы и хрусталика, отек головного и спинного мозга, нейровоспаление и боль.
Другие неожиданные роли водоселективных аквапоринов включают их участие в прозрачности роговицы и хрусталика, отек головного и спинного мозга, нейровоспаление и боль.
Акваглицеропорины млекопитающих включают AQP3, AQP7 и AQP9. AQP3 экспрессируется в базальном слое пролиферирующих кератиноцитов эпидермиса. У мышей, лишенных AQP3, снижена гидратация и эластичность кожи, что связано с нарушением транспорта глицерина из крови в эпидермис и, как следствие, снижением содержания глицерина в эпидермисе и роговом слое. Уменьшение содержания глицерина ухудшает увлажнение и эластичность кожи, так как глицерин является основным увлажнителем (осмолитом, удерживающим воду). Снижение содержания глицерина также нарушает эпидермальную пролиферацию, поскольку глицерин является важным метаболитом эпидермальных клеток, участвующим в образовании АТФ и биосинтезе мембранных липидов. В косметической промышленности наблюдается значительный интерес к AQP3, при этом заявленные на рынке продукты повышают экспрессию AQP3.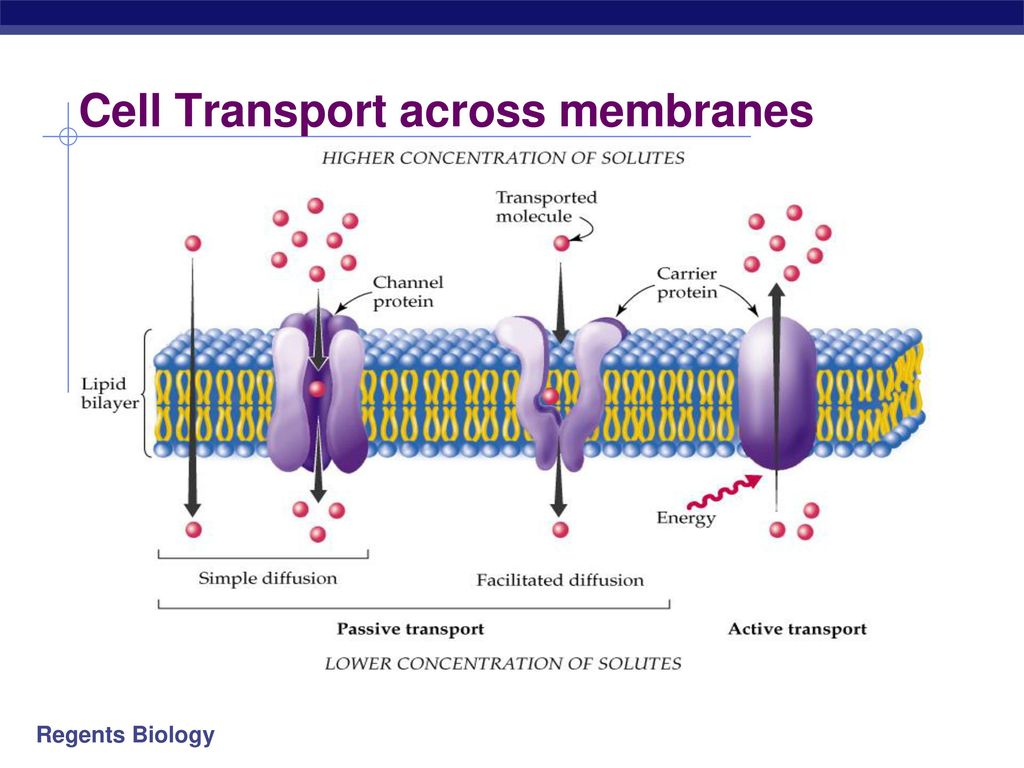 Недавние исследования показали важную роль AQP3 в функции макрофагов и Т-лимфоцитов, возможно, с участием AQP3-облегченного H9.0041 2 O 2 транспорт. Другое интригующее наблюдение, сделанное на мышах с недостатком AQP7, представляет собой прогрессирующее ожирение с гипертрофией адипоцитов, которое, по-видимому, является следствием нарушения оттока глицерина из адипоцитов. Снижение проницаемости плазматической мембраны для глицерина в результате дефицита AQP7 приводит к внутриклеточному накоплению глицерина и триглицеридов (2), что указывает на возможность активации AQP7 для уменьшения жировой массы при ожирении. Наконец, предполагается, что экспрессия AQP9 в гепатоцитах способствует поглощению печеночного глицерина, хотя значение поглощения печеночного глицерина в метаболизме человека неясно.
Недавние исследования показали важную роль AQP3 в функции макрофагов и Т-лимфоцитов, возможно, с участием AQP3-облегченного H9.0041 2 O 2 транспорт. Другое интригующее наблюдение, сделанное на мышах с недостатком AQP7, представляет собой прогрессирующее ожирение с гипертрофией адипоцитов, которое, по-видимому, является следствием нарушения оттока глицерина из адипоцитов. Снижение проницаемости плазматической мембраны для глицерина в результате дефицита AQP7 приводит к внутриклеточному накоплению глицерина и триглицеридов (2), что указывает на возможность активации AQP7 для уменьшения жировой массы при ожирении. Наконец, предполагается, что экспрессия AQP9 в гепатоцитах способствует поглощению печеночного глицерина, хотя значение поглощения печеночного глицерина в метаболизме человека неясно.
Провокационные данные указывают на причастность аквапоринов к некоторым видам рака. В большом количестве описательной литературы сообщается о сильной экспрессии аквапоринов при раке головного мозга, кожи, желудочно-кишечного тракта, легких и других видах рака, часто с корреляцией между экспрессией аквапоринов и степенью опухоли.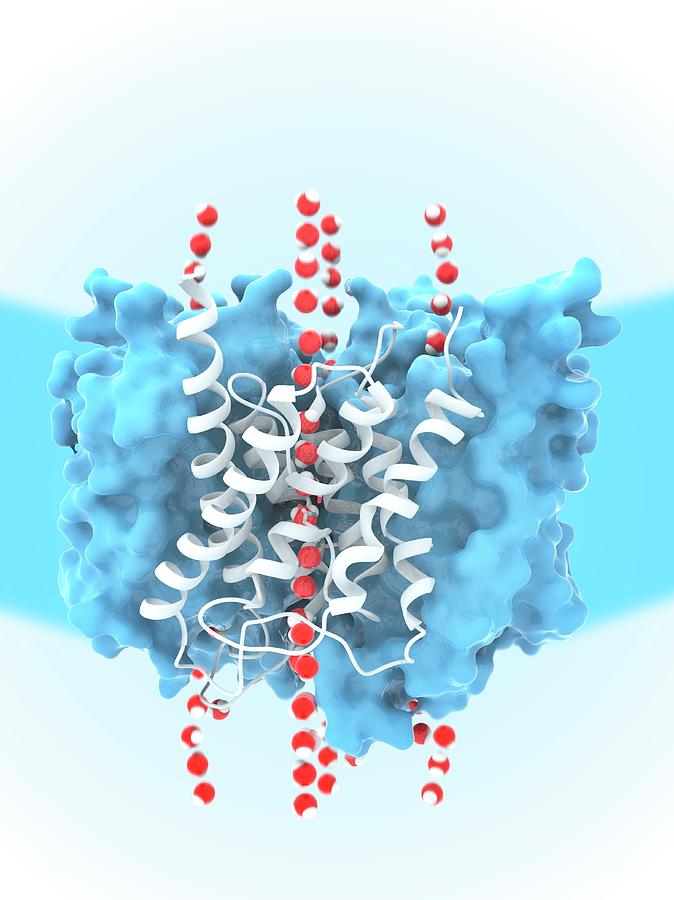 Опухоли часто сверхэкспрессируют аквапорины, обнаруженные в типе клеток происхождения, таких как AQP4 в глиобластомах, происходящих из астроцитов, хотя иногда опухолевые клетки экспрессируют аквапорины, которые не наблюдаются в клетках происхождения. Было предложено несколько механизмов, которые связывают экспрессию аквапоринов с раком. AQP1 сильно экспрессируется в микрососудах опухоли, и его делеция у мышей снижает ангиогенез опухоли. Экспрессия различных аквапоринов в опухолевых клетках увеличивает их миграцию и метастатический потенциал в клеточных культурах и животных моделях. AQP3 увеличивает пролиферацию различных опухолевых клеток, а мыши, лишенные AQP3, обладают высокой устойчивостью к раку кожи. Хотя многие вопросы еще предстоит решить, ингибирование аквапорина для лечения рака является интригующей идеей.
Опухоли часто сверхэкспрессируют аквапорины, обнаруженные в типе клеток происхождения, таких как AQP4 в глиобластомах, происходящих из астроцитов, хотя иногда опухолевые клетки экспрессируют аквапорины, которые не наблюдаются в клетках происхождения. Было предложено несколько механизмов, которые связывают экспрессию аквапоринов с раком. AQP1 сильно экспрессируется в микрососудах опухоли, и его делеция у мышей снижает ангиогенез опухоли. Экспрессия различных аквапоринов в опухолевых клетках увеличивает их миграцию и метастатический потенциал в клеточных культурах и животных моделях. AQP3 увеличивает пролиферацию различных опухолевых клеток, а мыши, лишенные AQP3, обладают высокой устойчивостью к раку кожи. Хотя многие вопросы еще предстоит решить, ингибирование аквапорина для лечения рака является интригующей идеей.
Одно редкое наследственное заболевание вызывается мутациями потери функции в AQP2, водном канале, экспрессирующемся в собирательных трубочках почек. AQP2 способствует трансэпителиальному всасыванию воды в собирательных трубочках почек в ответ на антидиуретический гормон, и этот процесс включает экзоцитарную вставку AQP2-содержащих везикул в апикальную мембрану клетки. Мутации в AQP2, которые нарушают его клеточный транспорт или функцию транспорта воды, приводят к заболеванию нефрогенным несахарным диабетом, при котором выделяются большие объемы разбавленной мочи, иногда превышающие 30 литров в день. Мутации в AQP0 (первоначально названном «основным внутренним белком волокон хрусталика») связаны с врожденными катарактами; однако механизм катарактогенеза неизвестен, поскольку неясно, заключается ли основная функция AQP0 в структуре хрусталика или в водопроницаемости клеток волокон хрусталика. Мутации потери функции в нескольких других аквапоринах были идентифицированы у небольшого числа людей, хотя ни одна из них, по-видимому, не связана со значительным заболеванием. Интересное аутоиммунное неврологическое заболевание, оптиконейромиелит, вызывается аутоантителами, направленными против внеклеточных эпитопов на AQP4. Связывание аутоантител вызывает комплемент- и клеточно-опосредованную цитотоксичность астроцитов, что приводит к воспалению с высвобождением цитокинов, инфильтрацией лейкоцитов и нарушением гематоэнцефалического барьера.
Мутации в AQP2, которые нарушают его клеточный транспорт или функцию транспорта воды, приводят к заболеванию нефрогенным несахарным диабетом, при котором выделяются большие объемы разбавленной мочи, иногда превышающие 30 литров в день. Мутации в AQP0 (первоначально названном «основным внутренним белком волокон хрусталика») связаны с врожденными катарактами; однако механизм катарактогенеза неизвестен, поскольку неясно, заключается ли основная функция AQP0 в структуре хрусталика или в водопроницаемости клеток волокон хрусталика. Мутации потери функции в нескольких других аквапоринах были идентифицированы у небольшого числа людей, хотя ни одна из них, по-видимому, не связана со значительным заболеванием. Интересное аутоиммунное неврологическое заболевание, оптиконейромиелит, вызывается аутоантителами, направленными против внеклеточных эпитопов на AQP4. Связывание аутоантител вызывает комплемент- и клеточно-опосредованную цитотоксичность астроцитов, что приводит к воспалению с высвобождением цитокинов, инфильтрацией лейкоцитов и нарушением гематоэнцефалического барьера.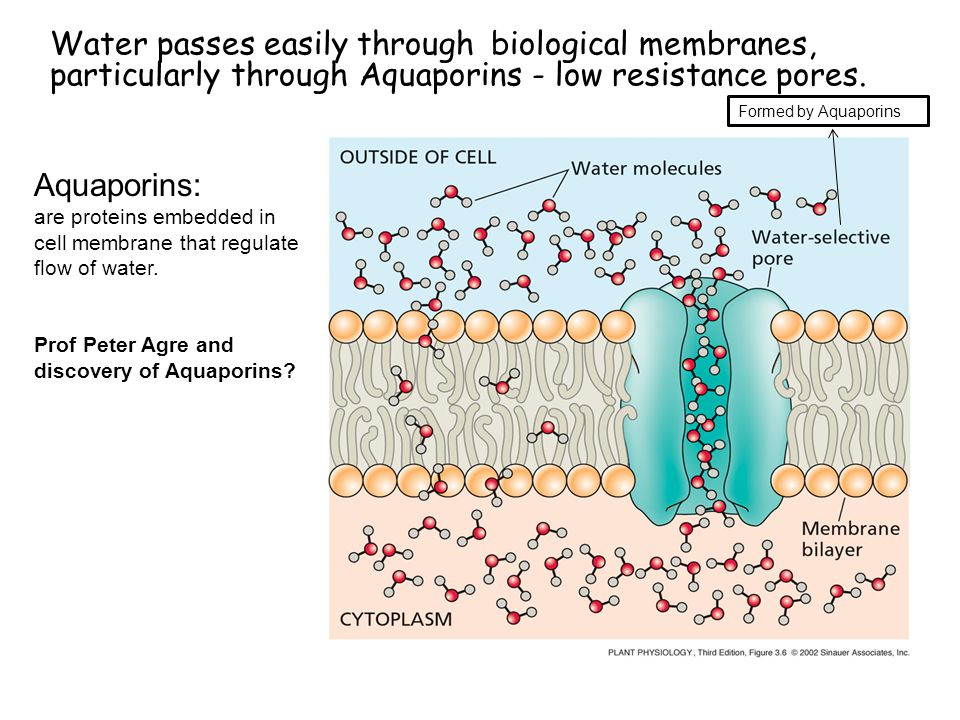 Воспалительные демиелинизирующие поражения спинного мозга и зрительного нерва приводят к параличу и слепоте. До сих пор не были обнаружены другие аутоиммунные заболевания, основанные на аквапорине.
Воспалительные демиелинизирующие поражения спинного мозга и зрительного нерва приводят к параличу и слепоте. До сих пор не были обнаружены другие аутоиммунные заболевания, основанные на аквапорине.
Существует значительный интерес, хотя и небольшой прогресс в области терапии на основе аквапоринов. Данные клеточных и животных моделей обеспечивают убедительное обоснование разработки модуляторов аквапоринов в качестве терапевтических средств: предполагается, что ингибиторы AQP1 будут полезны при рефрактерных к диуретикам отеках, опухолевом ангиогенезе и глаукоме; Ингибиторы AQP4 при некоторых формах отека и травм головного мозга; и ингибиторы AQP3 при некоторых видах рака. Повышающие регуляторы экспрессии некоторых аквапоринов имеют потенциальное терапевтическое значение при ожирении, заживлении ран и повреждении спинного мозга. Определенные соединения тяжелых металлов (ртуть, золото), которые неспецифически реагируют с сульфгидрилами белков, ингибируют водопроницаемость некоторых аквапоринов.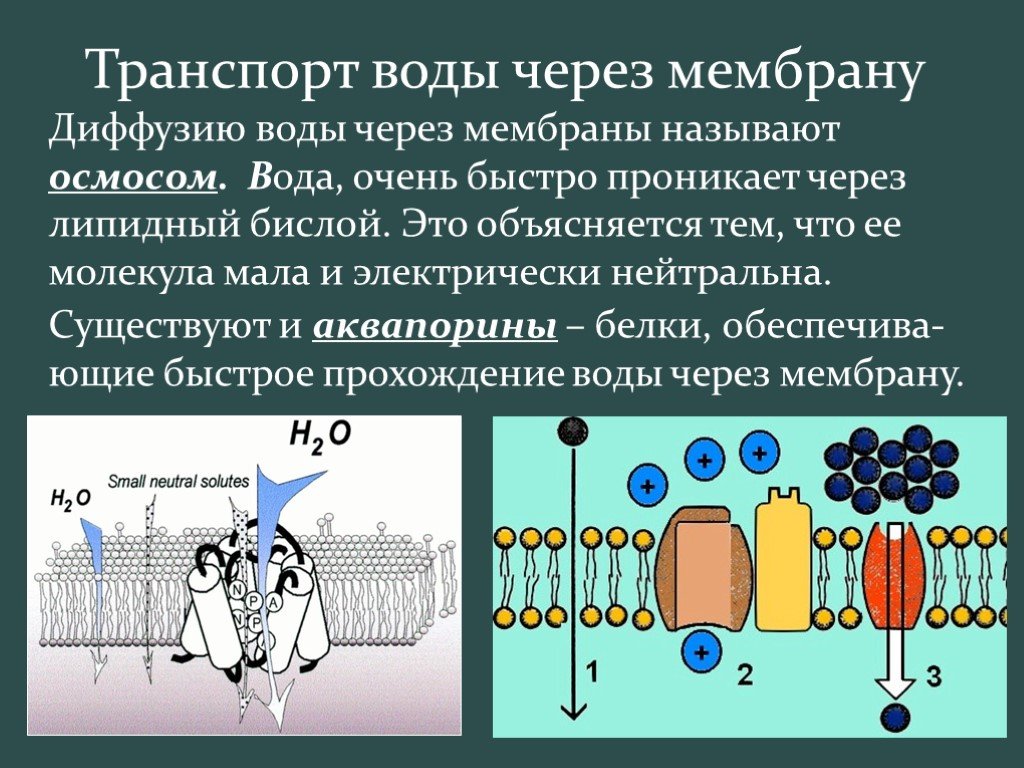 Тем не менее, идентификация нетоксичных низкомолекулярных ингибиторов аквапоринов оказалась невозможной, возможно, по совокупности причин, включая трудности в функциональных скрининговых анализах и присущую аквапоринам невосприимчивость к открытию лекарств (так называемая нелекарственность). Одной из областей недавнего прогресса является терапия на основе AQP4 для лечения оптикомиелита. Идея состоит в том, чтобы заблокировать связывание патогенных аутоантител с астроцитом AQP4, что может обеспечить целенаправленный неиммуносупрессивный подход к блокированию события, инициирующего заболевание, при оптикомиелите. Одним из подходов была разработка непатогенного, прочно связывающегося антитела против AQP4 («аквапорумаб»), которое конкурирует с патогенными аутоантителами; другим подходом была идентификация с помощью высокопроизводительного скрининга низкомолекулярных блокаторов взаимодействия аутоантитело-AQP4.
Тем не менее, идентификация нетоксичных низкомолекулярных ингибиторов аквапоринов оказалась невозможной, возможно, по совокупности причин, включая трудности в функциональных скрининговых анализах и присущую аквапоринам невосприимчивость к открытию лекарств (так называемая нелекарственность). Одной из областей недавнего прогресса является терапия на основе AQP4 для лечения оптикомиелита. Идея состоит в том, чтобы заблокировать связывание патогенных аутоантител с астроцитом AQP4, что может обеспечить целенаправленный неиммуносупрессивный подход к блокированию события, инициирующего заболевание, при оптикомиелите. Одним из подходов была разработка непатогенного, прочно связывающегося антитела против AQP4 («аквапорумаб»), которое конкурирует с патогенными аутоантителами; другим подходом была идентификация с помощью высокопроизводительного скрининга низкомолекулярных блокаторов взаимодействия аутоантитело-AQP4.
В наших знаниях о клеточных механизмах некоторых функций аквапоринов, таких как миграция клеток, облегчаемая аквапорином, пролиферация клеток и явления нейровозбуждения, остаются значительные пробелы. Хотя большая часть низко висящих плодов в области аквапоринов уже собрана и переварена, как и в области структуры белков аквапоринов и фенотипического анализа мышей с нокаутом, новые открытия и идеи продолжают появляться. Убедительные недавние данные требуют дальнейшего изучения аквапоринов при раке, функции иммунных клеток и ожирении. Наконец, несмотря на проблемы и ограниченный прогресс в идентификации ингибиторов аквапоринов, у терапевтических средств на основе аквапоринов остаются широкие возможности.
Хотя большая часть низко висящих плодов в области аквапоринов уже собрана и переварена, как и в области структуры белков аквапоринов и фенотипического анализа мышей с нокаутом, новые открытия и идеи продолжают появляться. Убедительные недавние данные требуют дальнейшего изучения аквапоринов при раке, функции иммунных клеток и ожирении. Наконец, несмотря на проблемы и ограниченный прогресс в идентификации ингибиторов аквапоринов, у терапевтических средств на основе аквапоринов остаются широкие возможности.
- Карбри Дж. М., Агре П. Открытие аквапоринов и разработка в этой области. Ручная работа Эксп. Фармакол. 2009; 190:3–28. [PubMed] [Google Scholar]
- Maurel C, Verdoucq L, Luu DT, Santoni V. Аквапорины растений: мембранные каналы с множеством интегрированных функций. Анну. Преподобный завод биол. 2008; 59: 595–624. [PubMed] [Google Scholar]
- Papadopoulos MC, Verkman AS. Аквапорин 4 и оптиконейромиелит. Ланцет Нейрол. 2012; 11: 535–544. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Веркман А.
 С. Аквапорины в клинической медицине. Анну. преподобный мед. 2012;63:303–316. [Бесплатная статья PMC] [PubMed] [Google Scholar]
С. Аквапорины в клинической медицине. Анну. преподобный мед. 2012;63:303–316. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Walz T, Fujiyoshi Y, Engel A. Структура AQP и функциональные последствия. Ручная работа Эксп. Фармакол. 2009; 19:31–56. [PubMed] [Академия Google]
Структура, динамика и функция аквапоринов
2004 Победитель
Конкурс визуализации в науке и технике,
Организовано
Национальный научный фонд и
Научный журнал.
(См. соответствующую статью в Science.)
Наш фильм о проникновении воды и 2003 г.
Нобелевская премия по химии
Скачать подробный фильм о проникновении воды ( 13M
Искусство водного транспорта в аквапоринах
Аквапорины представляют собой мембранные водные каналы, которые играют
решающую роль в контроле содержания воды в клетках. Эти каналы
широко распространены во всех царствах жизни, включая бактерии,
растения, млекопитающие. Было обнаружено более десяти различных аквапоринов.
в организме человека, а также ряд заболеваний, таких как врожденная катаракта и
нефрогенный несахарный диабет, связаны с нарушением функции
эти каналы. Они образуют тетрамеры в клеточной мембране и облегчают
перенос воды и, в некоторых случаях, других малых растворенных веществ через
мембрана. Однако водяные поры совершенно непроницаемы для заряженных
видов, таких как протоны, замечательное свойство, которое имеет решающее значение для
сохранения электрохимического потенциала мембраны, но парадоксально при
в то же время, поскольку протоны обычно легко переносятся через
молекулы воды. Результаты нашего моделирования теперь предоставили новые
понимание механизма, лежащего в основе этого удивительного свойства. Вода
Молекулы, проходящие через канал, вынуждаются электростатическим действием белка.
силы, чтобы перевернуться в центре канала (см. анимацию),
тем самым нарушая альтернативное донорно-акцепторное соглашение, которое
необходимо для переноса протона (полную историю читайте в нашем
Наука
бумага).
Было обнаружено более десяти различных аквапоринов.
в организме человека, а также ряд заболеваний, таких как врожденная катаракта и
нефрогенный несахарный диабет, связаны с нарушением функции
эти каналы. Они образуют тетрамеры в клеточной мембране и облегчают
перенос воды и, в некоторых случаях, других малых растворенных веществ через
мембрана. Однако водяные поры совершенно непроницаемы для заряженных
видов, таких как протоны, замечательное свойство, которое имеет решающее значение для
сохранения электрохимического потенциала мембраны, но парадоксально при
в то же время, поскольку протоны обычно легко переносятся через
молекулы воды. Результаты нашего моделирования теперь предоставили новые
понимание механизма, лежащего в основе этого удивительного свойства. Вода
Молекулы, проходящие через канал, вынуждаются электростатическим действием белка.
силы, чтобы перевернуться в центре канала (см. анимацию),
тем самым нарушая альтернативное донорно-акцепторное соглашение, которое
необходимо для переноса протона (полную историю читайте в нашем
Наука
бумага).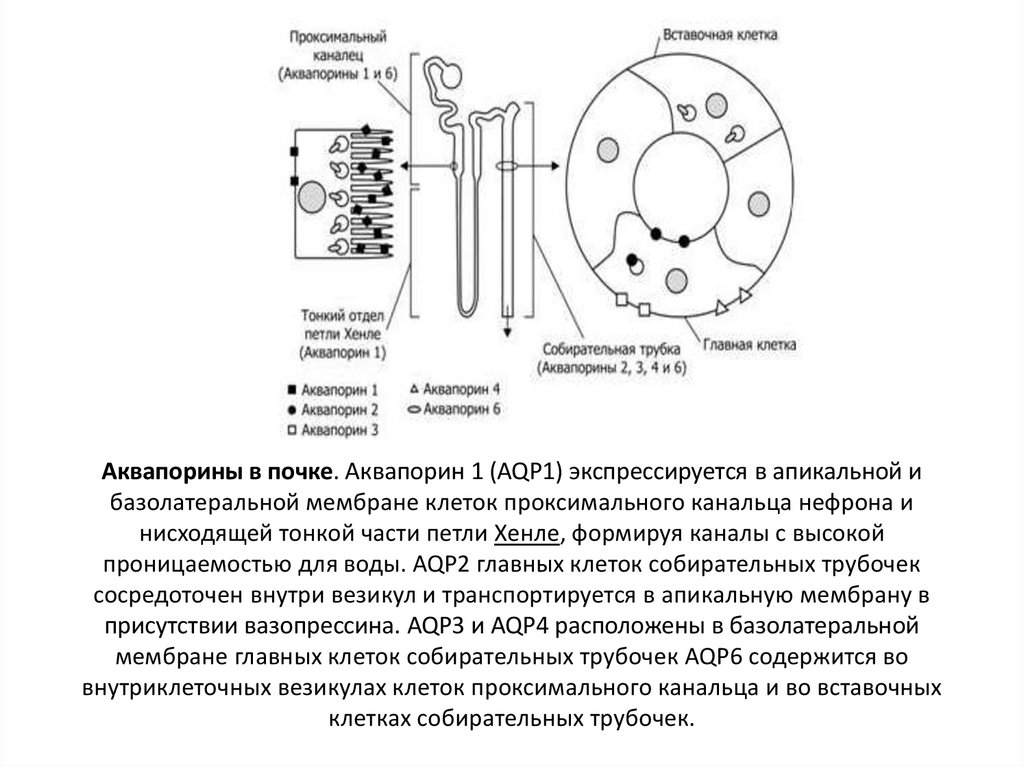
Функциональное значение своеобразной белковой архитектуры
В 2000 году лаборатория Страуда в Калифорнийском университете в Сан-Франциско преуспела при решении первой структуры аквапорина с высоким разрешением с помощью рентгеновских лучей кристаллография. Исследуемая структура была одной из E. coli . посредник поглощения глицерина (GlpF), который представляет собой акваглицеропорин, т.е. канал также проницаем для небольших линейных молекул сахара например глицерин. Моделирование наносекундной МД тетрамерного GlpF в гидратированный участок липидного бислоя POPE характеризовал полный путь проводимости подложки в канале. Анализ водородной связи взаимодействия подложки с внутренней частью канала также впервые объяснил, почему эти каналы включают в себя две характерные петли, в том числе энергетически невыгодные элементы вторичной структуры, которые сохраняются во всем аквапорине семья (Дженсен и др., Структура, 2001).
Энергетика проникновения сахара
Затем мы исследовали энергетику транспорта
мероприятие, чтобы понять, какие барьеры необходимо преодолеть субстрату во время
его прохождения через канал.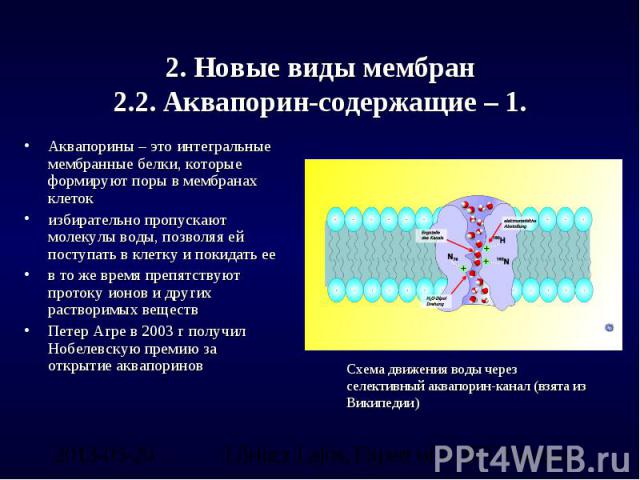 Для описания бесплатного
энергетическом профиле мы рассчитали потенциал средней силы для
полное событие проводимости от траекторий, по которым движение
глицерина через канал ускоряли, применяя внешние
сил. Этот метод, известный как управляемый
молекулярная динамика (SMD), позволяет наблюдать медленные события
в пределах доступного временного масштаба симуляций МД. Однако из-за
к неравновесному характеру траекторий, при анализе
В результате возникает проблема необратимой работы, которую необходимо
со скидкой. Используя тождество Ярзинского, равенство между
свободной энергии и работать в неравновесных системах, мы могли бы полностью
описать энергетику транспорта глицерина через канал.
рассчитанный потенциал средней силы захватывает основные сайты связывания
и барьеров в канале в близком согласии с результатами
равновесное МД моделирование и кристаллическая структура. Более того, это
имеет ярко выраженную асимметрию в своей форме, что свидетельствует о том, что
асимметричная структура белка может иметь функциональное значение для
эффективное поглощение молекул питательных веществ из окружающей среды.
Для описания бесплатного
энергетическом профиле мы рассчитали потенциал средней силы для
полное событие проводимости от траекторий, по которым движение
глицерина через канал ускоряли, применяя внешние
сил. Этот метод, известный как управляемый
молекулярная динамика (SMD), позволяет наблюдать медленные события
в пределах доступного временного масштаба симуляций МД. Однако из-за
к неравновесному характеру траекторий, при анализе
В результате возникает проблема необратимой работы, которую необходимо
со скидкой. Используя тождество Ярзинского, равенство между
свободной энергии и работать в неравновесных системах, мы могли бы полностью
описать энергетику транспорта глицерина через канал.
рассчитанный потенциал средней силы захватывает основные сайты связывания
и барьеров в канале в близком согласии с результатами
равновесное МД моделирование и кристаллическая структура. Более того, это
имеет ярко выраженную асимметрию в своей форме, что свидетельствует о том, что
асимметричная структура белка может иметь функциональное значение для
эффективное поглощение молекул питательных веществ из окружающей среды.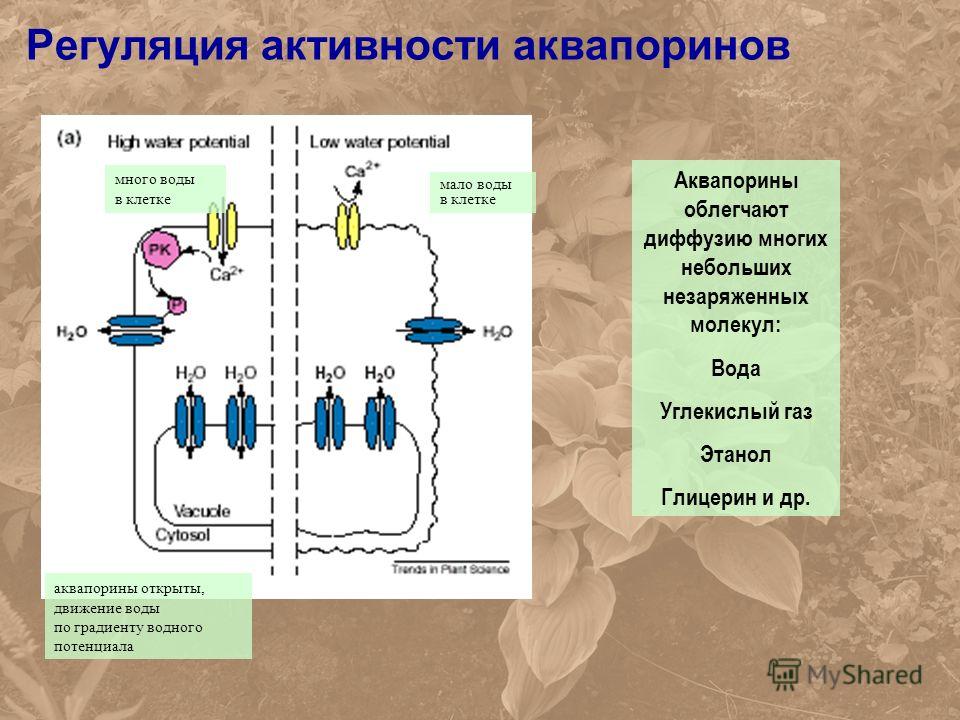 (Дженсен и др.
и др., ПНАС, 2002).
(Дженсен и др.
и др., ПНАС, 2002).
Что делает аквапорин глицериновым каналом
Аквапорины — очень удачное семейство мембранных белков,
которые, как известно, устойчивы к определению структуры. У нас есть
теперь структуры высокого разрешения нескольких AQP: GlpF, AQP1, AQP0 и
АкпЗ. Ожидается, что в ближайшее время появятся новые структуры. Наличие
структура двух AQP из E. coli , одна из которых представляет собой чистую воду
канал (AqpZ), а другой — глицериновый канал (GlpF), обеспечиваемый
нас с уникальной возможностью понять принципы селективности
используемые природой в использовании двух генетически и структурно высоко
гомологичные каналы для мембранного переноса различных материалов.
Сравнение рассчитанных барьеров для проводимости глицерина в
эти два канала показали, что AqpZ использует стерические барьеры.
чтобы глицерину было трудно проходить. На самом деле пора в
в целом уже, чем GlpF (см. рисунок ниже). Кажется, что природа
превратился в очень простой механизм, а именно настройку размера пор
канала, чтобы сделать два белка из одного семейства
проявляют различные свойства проводимости.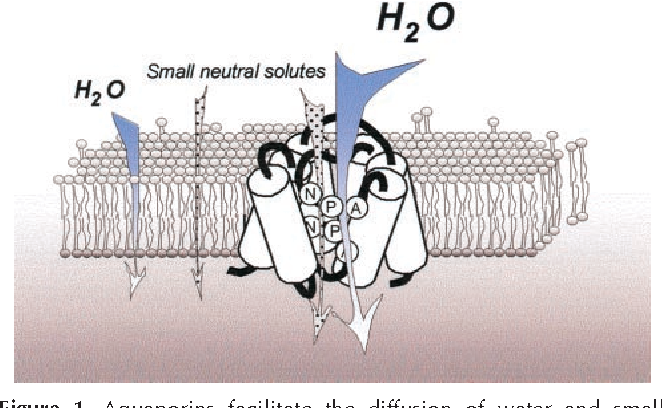 Прочитать всю историю в Wang, et
и др., СТРУКТУРА, 2005.
Прочитать всю историю в Wang, et
и др., СТРУКТУРА, 2005.
Подача давления в каналы
Для непосредственного сравнения результатов МД моделирование с биохимическими измерениями проводимости мембранные водные каналы, в которых используются градиенты осмотического давления чтобы вызвать поток воды через мембрану, мы разработали новый методология моделирования МД. Прилагая малые силы к воде молекул в объемной области (см. рисунок), гидростатическое давление создается градиент через мембрану. Градиент давления вызывает скорости проводимости, которые можно изучить с помощью моделирования МД, которые обычно ограничивается несколькими наносекундами. Метод был применен в моделирование проникновения воды через GlpF, и в результате в линейной корреляции между приложенным давлением и потоком (Zhu et al., Биофиз. Дж., 2002).
Запирание водных каналов
Проникновение воды через аквапорины является пассивным процессом, который следует направлению осмотического давления через мембрану. Хотя многие аквапорины функционируют как всегда открытые каналы, подгруппа аквапоринов, особенно у растений, выработала сложный молекулярный механизм, посредством которого канал может закрываться в ответ на суровые условия окружающей среды, при которых обмен воды может быть вредным для организма. организм. Примерами таких условий являются стресс от засухи и затопление, которые запускают определенные клеточные сигналы (дефосфорилирование и изменение pH), что приводит к закрытию канала. Недавно решенная структура аквапорина из шпината была смоделирована в различных условиях для исследования молекулярного механизма управления в этих мембранных каналах. Было обнаружено, что удлиненная цитоплазматическая петля у гейт-компетентных аквапоринов физически перекрывает вход поры воды в закрытый канал и блокирует доступ молекул воды в пору. Смещение этой петли в ответ на фосфорилирование, наблюдаемое при моделировании, удаляет петлю из цитоплазматического входа в пору. Кроме того, гидрофобная аминокислота, которая конформационно тесно связана с этой петлей, будет вытягиваться из канала в результате движения петли.
Хотя многие аквапорины функционируют как всегда открытые каналы, подгруппа аквапоринов, особенно у растений, выработала сложный молекулярный механизм, посредством которого канал может закрываться в ответ на суровые условия окружающей среды, при которых обмен воды может быть вредным для организма. организм. Примерами таких условий являются стресс от засухи и затопление, которые запускают определенные клеточные сигналы (дефосфорилирование и изменение pH), что приводит к закрытию канала. Недавно решенная структура аквапорина из шпината была смоделирована в различных условиях для исследования молекулярного механизма управления в этих мембранных каналах. Было обнаружено, что удлиненная цитоплазматическая петля у гейт-компетентных аквапоринов физически перекрывает вход поры воды в закрытый канал и блокирует доступ молекул воды в пору. Смещение этой петли в ответ на фосфорилирование, наблюдаемое при моделировании, удаляет петлю из цитоплазматического входа в пору. Кроме того, гидрофобная аминокислота, которая конформационно тесно связана с этой петлей, будет вытягиваться из канала в результате движения петли. Вместе эти молекулярные события приводят к открытому каналу, проницаемому для молекул воды. Исследование появилось в Nature.
2006.
Вместе эти молекулярные события приводят к открытому каналу, проницаемому для молекул воды. Исследование появилось в Nature.
2006.
Запирание и ионная проводимость тетрамерной поры
AQP широко известны своими
высокая водопроницаемость. Однако их участие
в других клеточных функциях, включая проникновение малых молекул
кроме воды, а также межклеточная связь была
предложенный. Тетрамеризация является общей структурной особенностью AQP.
тот факт, что каждый из четырех мономеров образует функционально независимую воду
поры, но требуют тетрамерной организации для функционирования, предполагает
синергетическое преимущество олигомеризации и, таким образом, заставляет
анализ потенциальной роли центральной поры в AQP. Ан
интересным предположением является возможное участие центральной поры
в ионной проводимости при активации цГМФ.
Используя МД-моделирование встроенных в мембрану моделей AQP1, мы получили
исследовал это свойство AQP1, чтобы определить, как и при каком
конформационные и гидратационные условия, центральная пора может проводить
ионов и как регулируется проводимость.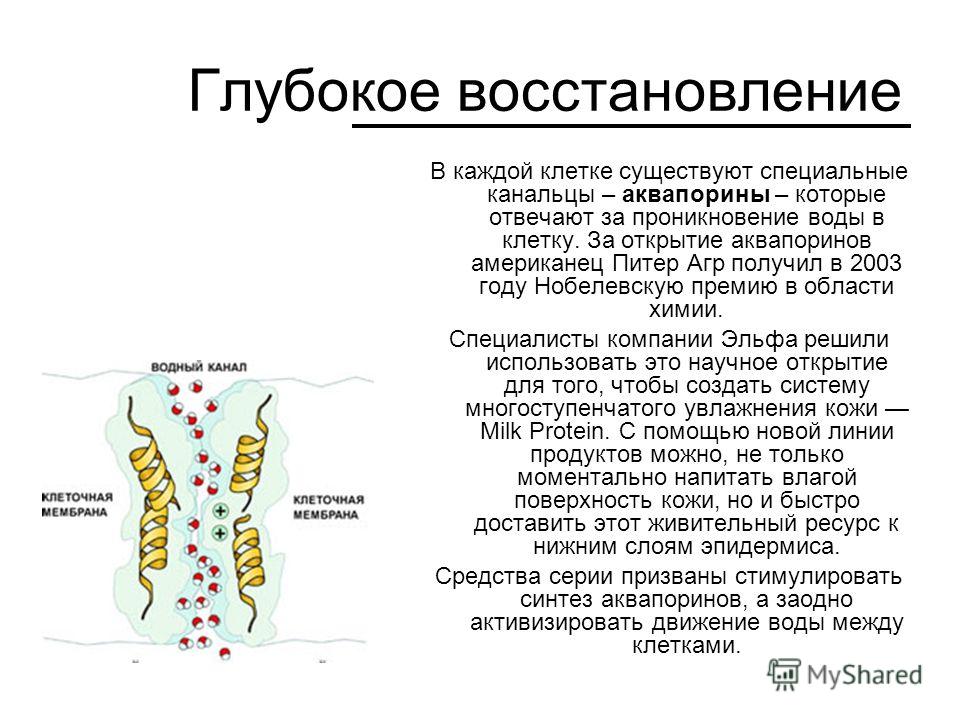 Один из цитоплазматических
петли, а именно богатая аргинином петля D, была предложена нашим
симуляции, чтобы играть ключевую роль в цГМФ-опосредованной активации
центральная пора. Предполагаемая роль петли D была проверена
экспериментально разработанным
мутант петли D, демонстрирующий полную потерю ионной проводимости (Yu et al.,
Структура, 2006).
Один из цитоплазматических
петли, а именно богатая аргинином петля D, была предложена нашим
симуляции, чтобы играть ключевую роль в цГМФ-опосредованной активации
центральная пора. Предполагаемая роль петли D была проверена
экспериментально разработанным
мутант петли D, демонстрирующий полную потерю ионной проводимости (Yu et al.,
Структура, 2006).
Молекулы газа добираются до клетки
Каждое утро многие люди едут на работу, а другие едут на велосипеде,
автобус или метро.
Точно так же различные биомолекулы в организме человека также достигают своего
назначения в различных манерах.
Например, чтобы пересечь клеточную мембрану, небольшие гидрофобные молекулы газа диффундируют через липидный слой.
бислой, а молекулы воды проходят через аквапорины (AQP).
Интересно, как на работу можно добираться как на автобусе, так и на
недавно было обнаружено, что некоторые молекулы газа могут иметь большее
чем один путь пересечения мембраны, т. е. помимо диффузии через
липиды, кислород и углекислый газ также могут проходить через AQP. Однако пути, по которым идут эти газовые молекулы, оставались неясными.
Используя молекулярную динамику, выполненную с
НАМД, мы исследовали газ
проницаемость AQP1 с
два взаимодополняющих метода (явное моделирование диффузии газа и неявное моделирование лиганда).
выборка). Результаты моделирования показывают, что хотя четыре
мономерные поры AQP1 функционируют как водные каналы,
центральная пора AQP1 может служить путем для молекул газа
пересекают мембрану (Wang et al., Journal of Structural Biology, 2007).
Однако пути, по которым идут эти газовые молекулы, оставались неясными.
Используя молекулярную динамику, выполненную с
НАМД, мы исследовали газ
проницаемость AQP1 с
два взаимодополняющих метода (явное моделирование диффузии газа и неявное моделирование лиганда).
выборка). Результаты моделирования показывают, что хотя четыре
мономерные поры AQP1 функционируют как водные каналы,
центральная пора AQP1 может служить путем для молекул газа
пересекают мембрану (Wang et al., Journal of Structural Biology, 2007).
Молекулярная полоса препятствий
Биологические клетки защищают свою внутреннюю часть через свои клеточные мембраны, но при этом полагаются на импорт питательных веществ.
Они развились для этого импорта быстрых проводящих каналов, которые включают надежные контрольные точки, различающие
желательные и нежелательные соединения. Контрольно-пропускной пункт создает настоящую полосу препятствий, которую
соединения могут быстро пройти. Понимание конструкции канала затруднено из-за отсутствия подробных экспериментальных данных.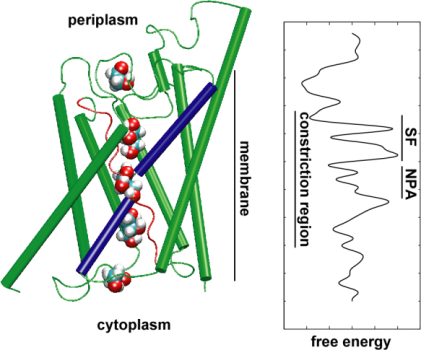 данные о динамике питательных веществ. В настоящее время наиболее подробная информация поступает при просмотре динамики канала.
вычислительно, начиная со статических кристаллографических структур. В недавнем исследовании изучалось, как глицерины,
небольшие молекулы питательных веществ, необходимые некоторым бактериям, проходят через контрольно-пропускные пункты, реализованные через
глицериновый канал GlpF. GlpF предоставляет четыре параллельных канала, которые контролировались с помощью вычислений с использованием NAMD и нового алгоритма, который исследует энергетику канала достаточно быстро, чтобы быть методологически осуществимым на современных компьютерах. Результаты показывают, как физические характеристики глицерина, их способность образовывать так называемые водородные связи, их электрические дипольные моменты, их диффузионная подвижность и их внутренняя гибкость исследуются вдоль канала (Henin et al., Biophysical Journal, в прессе).
данные о динамике питательных веществ. В настоящее время наиболее подробная информация поступает при просмотре динамики канала.
вычислительно, начиная со статических кристаллографических структур. В недавнем исследовании изучалось, как глицерины,
небольшие молекулы питательных веществ, необходимые некоторым бактериям, проходят через контрольно-пропускные пункты, реализованные через
глицериновый канал GlpF. GlpF предоставляет четыре параллельных канала, которые контролировались с помощью вычислений с использованием NAMD и нового алгоритма, который исследует энергетику канала достаточно быстро, чтобы быть методологически осуществимым на современных компьютерах. Результаты показывают, как физические характеристики глицерина, их способность образовывать так называемые водородные связи, их электрические дипольные моменты, их диффузионная подвижность и их внутренняя гибкость исследуются вдоль канала (Henin et al., Biophysical Journal, в прессе).
Наши исследования аквапоринов в новостях
| Аквапорин Тим
|
Публикации
База данных публикаций Диффузия глицерина через Escherichia coli акваглицеропорин GlpF.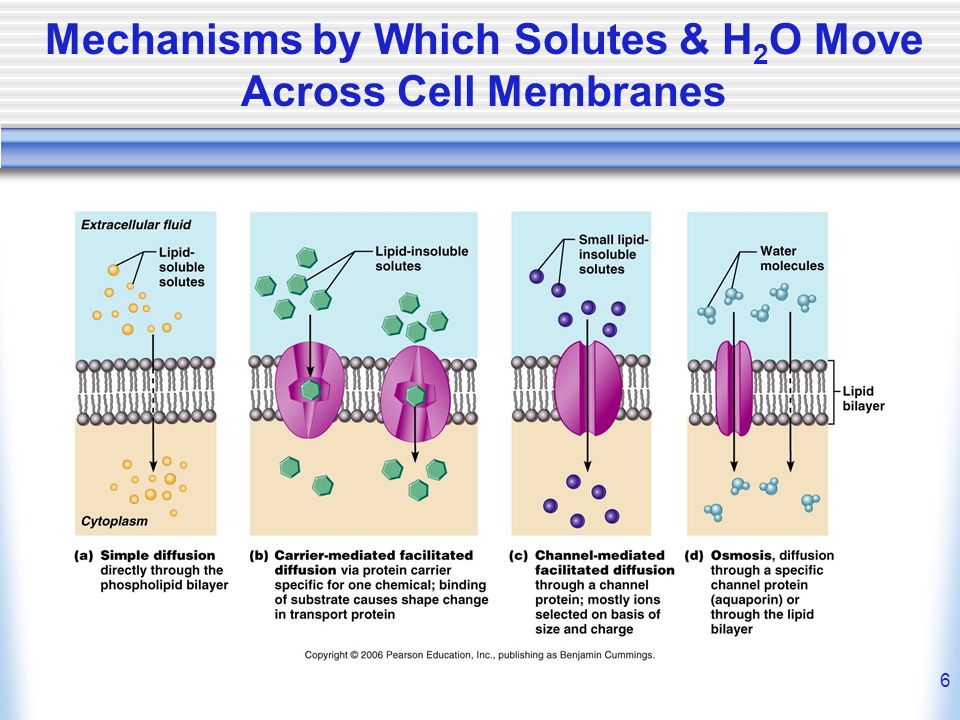 Жером Энен, Эмад Тайхоршид, Клаус Шультен и Кристоф Шипо. Биофизический журнал , 94:832-839, 2008.
Исследование газопроницаемости клеточных мембран и мембранных каналов с помощью молекулярной динамики.
Йи Ван, Джорди Коэн, Уолтер Ф. Борон, Клаус Шультен и Эмад Тайхоршид. Журнал структурной биологии , 157:534-544, 2007.
Механизм стробирования и ионная проводимость возможной тетрамерной поры в Аквапорине-1.
Джин Ю, Андреа Дж. Юл, Клаус Шультен и Эмад Тайхоршид. Структура , 14:1411-1423, 2006.
Структурный механизм аквапоринового гейтирования растений.
С. Торнрот-Хорсфилд, Ю. Ван, К. Хедфальк, У. Йохансон, М. Карлссон, Э. Тайхоршид, Р. Нойце и П. Кьельбом. Природа , 439:688-694, 2006.
Что делает аквапорин глицериновым каналом: сравнительное исследование AqpZ и GlpF.
Йи Ван, Клаус Шультен и Эмад Тайхоршид. Структура , 13:1107-1118, 2005.
Кинетическая теория и моделирование одноканального водного транспорта.
Эмад Тайхоршид, Фанцян Чжу и Клаус Шультен.
Жером Энен, Эмад Тайхоршид, Клаус Шультен и Кристоф Шипо. Биофизический журнал , 94:832-839, 2008.
Исследование газопроницаемости клеточных мембран и мембранных каналов с помощью молекулярной динамики.
Йи Ван, Джорди Коэн, Уолтер Ф. Борон, Клаус Шультен и Эмад Тайхоршид. Журнал структурной биологии , 157:534-544, 2007.
Механизм стробирования и ионная проводимость возможной тетрамерной поры в Аквапорине-1.
Джин Ю, Андреа Дж. Юл, Клаус Шультен и Эмад Тайхоршид. Структура , 14:1411-1423, 2006.
Структурный механизм аквапоринового гейтирования растений.
С. Торнрот-Хорсфилд, Ю. Ван, К. Хедфальк, У. Йохансон, М. Карлссон, Э. Тайхоршид, Р. Нойце и П. Кьельбом. Природа , 439:688-694, 2006.
Что делает аквапорин глицериновым каналом: сравнительное исследование AqpZ и GlpF.
Йи Ван, Клаус Шультен и Эмад Тайхоршид. Структура , 13:1107-1118, 2005.
Кинетическая теория и моделирование одноканального водного транспорта.
Эмад Тайхоршид, Фанцян Чжу и Клаус Шультен. Ин С. Ип, редактор, Справочник по моделированию материалов, Vol. I: Методы и модели , стр. 1797-1822. Спрингер, Нидерланды, 2005 г.
К пониманию мембранных каналов.
Эмад Тайхоршид, Хорди Коэн, Алексей Аксиментьев, Маркос Сотомайор и Клаус Шультен. Борис Мартинак и Анджей Кубальский, редакторы, Бактериальные ионные каналы и их эукариотические гомологи , стр. 153-190. ASM Press, Вашингтон, округ Колумбия, 2005 г.
Модель коллективной диффузии для проникновения воды через микроскопические каналы.
Фанцян Чжу, Эмад Тайхоршид и Клаус Шультен. Physical Review Letters , 93:224501, 2004 г. (4 страницы).
Компьютерные исследования мембранных каналов.
Бенуа Ру и Клаус Шультен. Структура , 12:1343-1351, 2004.
Ин С. Ип, редактор, Справочник по моделированию материалов, Vol. I: Методы и модели , стр. 1797-1822. Спрингер, Нидерланды, 2005 г.
К пониманию мембранных каналов.
Эмад Тайхоршид, Хорди Коэн, Алексей Аксиментьев, Маркос Сотомайор и Клаус Шультен. Борис Мартинак и Анджей Кубальский, редакторы, Бактериальные ионные каналы и их эукариотические гомологи , стр. 153-190. ASM Press, Вашингтон, округ Колумбия, 2005 г.
Модель коллективной диффузии для проникновения воды через микроскопические каналы.
Фанцян Чжу, Эмад Тайхоршид и Клаус Шультен. Physical Review Letters , 93:224501, 2004 г. (4 страницы).
Компьютерные исследования мембранных каналов.
Бенуа Ру и Клаус Шультен. Структура , 12:1343-1351, 2004.
Молекулярные основы блокировки протонов в аквапоринах. Нилмадхаб Чакрабарти, Эмад Тайхоршид, Бенот Ру и Ргис Помс. Структура , 12: 65-74, 2004.
База данных публикаций Механизм исключения протонов в аквапориновых каналах. Боаз Илан, Эмад Тайхоршид, Клаус Шультен и Грегори А. Вот. БЕЛКИ: структура, функция и биоинформатика , 55:223-228, 2004.
Теория и моделирование водопроницаемости в аквапорине-1.
Фанцян Чжу, Эмад Тайхоршид и Клаус Шультен. Биофизический журнал , 86:50-57, 2004.
Электростатическая настройка проницаемости и селективности в водных каналах аквапорина.
Мортен Ø. Дженсен, Эмад Тайхоршид и Клаус Шультен. Биофизический журнал , 85:2884-2899, 2003.
Проводимость воды и протонов через углеродные нанотрубки как модели биологических каналов.
Фанцян Чжу и Клаус Шультен. Биофизический журнал , 85:236-244, 2003.
Глицериновая проводимость и физическая асимметрия глицеринового посредника Escherichia coli GlpF.
Дэю Лу, Пол Грейсон и Клаус Шультен. Биофизический журнал , 85:2977-2987, 2003.
Механизмы селективности в каналах и ферментах изучены с помощью интерактивной молекулярной динамики.
Пол Грейсон, Эмад Тайхоршид и Клаус Шультен. Биофизический журнал , 85:36-48, 2003.
Контроль селективности семейства водных каналов аквапоринов путем глобальной настройки ориентации.
Вот. БЕЛКИ: структура, функция и биоинформатика , 55:223-228, 2004.
Теория и моделирование водопроницаемости в аквапорине-1.
Фанцян Чжу, Эмад Тайхоршид и Клаус Шультен. Биофизический журнал , 86:50-57, 2004.
Электростатическая настройка проницаемости и селективности в водных каналах аквапорина.
Мортен Ø. Дженсен, Эмад Тайхоршид и Клаус Шультен. Биофизический журнал , 85:2884-2899, 2003.
Проводимость воды и протонов через углеродные нанотрубки как модели биологических каналов.
Фанцян Чжу и Клаус Шультен. Биофизический журнал , 85:236-244, 2003.
Глицериновая проводимость и физическая асимметрия глицеринового посредника Escherichia coli GlpF.
Дэю Лу, Пол Грейсон и Клаус Шультен. Биофизический журнал , 85:2977-2987, 2003.
Механизмы селективности в каналах и ферментах изучены с помощью интерактивной молекулярной динамики.
Пол Грейсон, Эмад Тайхоршид и Клаус Шультен. Биофизический журнал , 85:36-48, 2003.
Контроль селективности семейства водных каналов аквапоринов путем глобальной настройки ориентации.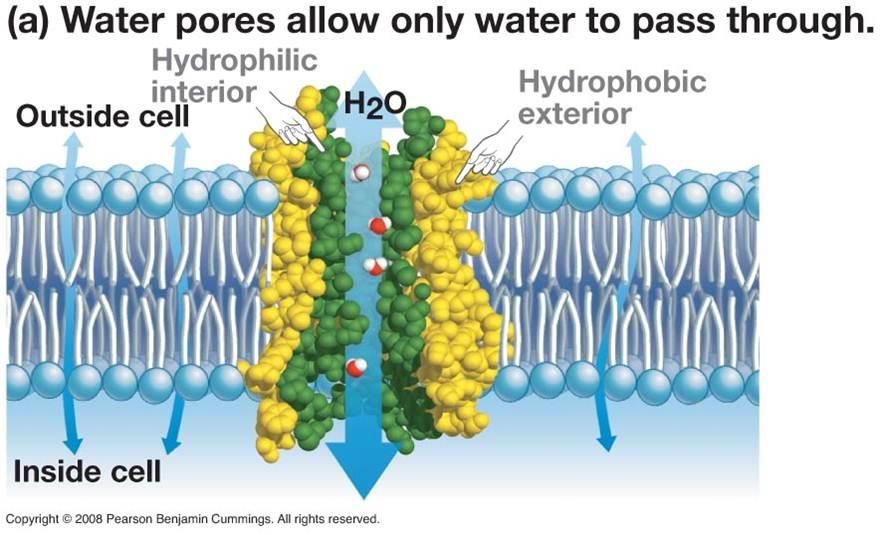

 С. Аквапорины в клинической медицине. Анну. преподобный мед. 2012;63:303–316. [Бесплатная статья PMC] [PubMed] [Google Scholar]
С. Аквапорины в клинической медицине. Анну. преподобный мед. 2012;63:303–316. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Добавить комментарий